“2017 年6月6日晚,復星醫藥 (股票代碼:600196.SH,02196.HK)宣布,其控股子公司復宏漢霖近日收到烏克蘭衛生部關於復宏漢霖自主研製的新葯——注射用重組抗HER2人源化單克隆抗體(以下簡稱“該新葯”)用於轉移性乳腺癌適應症的III期臨床試驗的批准。”
復宏漢霖HLX02項目“重組抗HER2人源化單克隆抗體”是赫賽汀®的生物類似葯。該新葯已於中國境內(不包括港澳台地區)完成I期臨床研究,I期臨床研究結果證實,該新葯安全、並與原研葯赫賽汀®等效;目前該項目國內III期臨床試驗研究已全面開展。
2017年1月,復宏漢霖就該新藥用於轉移性乳腺癌適應症向烏克蘭衛生部遞交了臨床試驗申請。根據 IMS MIDASTM的資料顯示,2016 年度,全球已上市 HER2 抑制劑於全球銷售額約為80.9億美元。截至2017年4月,復星醫藥現階段針對該新葯(包括轉移性乳腺癌適應症及轉移性胃癌適應症)已投入研發費用人民幣約2.02億元。
復星醫藥始終將創新研發作為企業發展的源動力,在全球範圍內有效配置資源,通過自主研發、技術引進、對外許可、合作研究,持續完善“仿創結合”的研發體系。復星醫藥現已在上海、重慶、台北、美國舊金山等地建立了高效的國際化研發團隊,通過不斷加大對研發平台的投入,推動新產品上市。作為復星醫藥大分子生物類似葯的研發重要平台,復宏漢霖將繼續秉承“質量、速度、創新”的核心理念,以“開發優質抗體藥物,造福全球病患”為使命,積極打造成為深得信賴,領先中國進而影響全球的生物製藥企業。
復宏漢霖臨床患者招募
按照本次臨床實施方案規定,入選的患者將被隨機分配接受注射用注射用重組抗HER2人源化單抗(HLX02)+多西他賽或者歐洲進口版曲妥珠單抗(赫賽汀)+多西他賽治療。
如果您(或者您認識的某人) 符合下列條件,將有可能參加本研究:
1. 年齡 ≥18 的女性;
2. 經組織學和/或細胞學確診的乳腺腺癌且HER2過表達
3. 患者既往未對複發或轉移性疾病進行過全身性化療、生物或靶向藥物治
4. 既往新/輔助階段(使用赫賽汀亦可)間隔12個月以上出現複發或者轉移
(您的醫生還會根據其他醫學標準進行檢查,以確定您是否適合參與本研究)
附參加機構中心
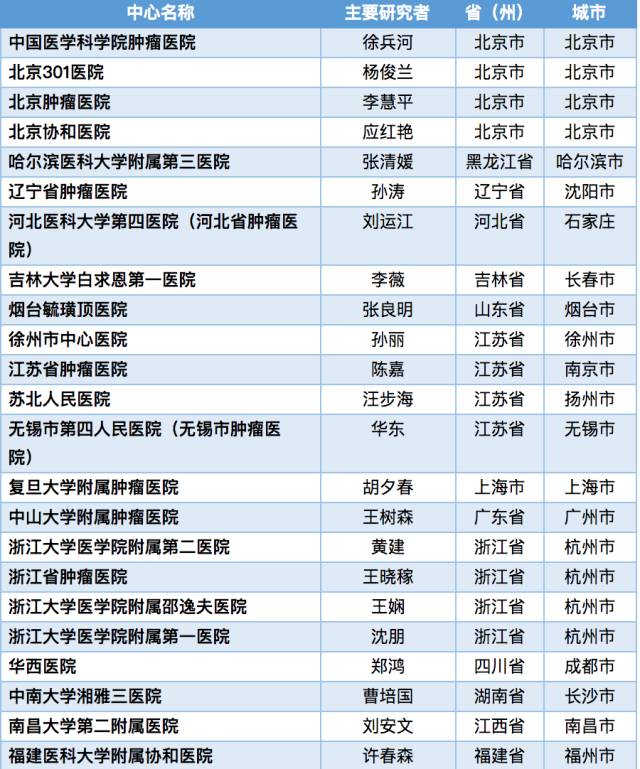

入選的患者將可獲得研究相關的免費藥物、免費檢查、交通補助。考慮參加或者希望了解更多有關的臨床研究信息,可與以上研究人員和機構(醫院)的藥物臨床試驗辦公室取得聯繫。
