近日,由美國胰腺學會/日本胰腺學會/中國胰腺病學會/國際胰腺病協會(APA/JPS/CAP/IAP)四大胰腺頂級學會聯合舉辦的2024年第55屆胰腺病學會年會在美國夏威夷成功舉行,該會議是全球胰腺病學領域最具影響力的學術盛會之一。會上,四川大學華西醫院曹丹教授團隊口頭報告了斯魯利單抗聯合化療及放療一線治療胰腺癌的II期研究數據。

H藥漢斯狀®(通用名:斯魯利單抗注射液)為復宏漢霖自主研發的重組人源化抗PD-1單抗注射液,也是全球首個獲批一線治療小細胞肺癌的抗PD-1單抗,已在中國和多個東南亞國家獲批,惠及患者約9萬人。此外,H藥一線治療廣泛期小細胞肺癌(ES-SCLC)的上市申請也已獲得歐盟EMA受理,有望於2025年獲得批准。聚焦肺癌和消化道腫瘤等瘤種,復宏漢霖積極推進H藥與公司其他產品的協同以及與創新療法的聯合,在全球同步開展10餘項腫瘤免疫聯合療法臨床試驗,於中國、美國、土耳其、波蘭、格魯吉亞等國家和地區累計入組超4600人。
消化道腫瘤是我國和全球範圍內高發病率和高死亡率的瘤種,主要包括結直腸癌、胃癌、肝癌、食管癌、胰腺癌和膽囊膽管癌。根據2022年全球癌症統計數據,全球約有490萬例新發消化道癌症病例和332萬例死亡病例,占所有癌症發病例約25%,占癌症相關死亡的34%以上[1]。針對消化道腫瘤,H藥聯合化療治療不可切除局部晚期/復發或轉移性食管鱗癌(ESCC)的一線治療方案已於2023年9月獲得中國國家藥監局(NMPA)批准上市,為我國食管鱗癌患者帶來了免疫治療新選擇。與此同時,該產品在胃癌新輔助/輔助方面已進入III期臨床研究,有望使胃癌患者在前線便從腫瘤免疫療法中獲益。
以下為此次發布的詳細信息:
論文題目:AG方案(白蛋白紫杉醇+吉西他濱)聯合斯魯利單抗及立體定向體放療(SBRT)一線治療局晚期及轉移性胰腺癌的II期臨床研究
牽頭主要研究者:曹丹 四川大學華西醫院
報告人:成科,四川大學華西醫院
報告時間:2024年12月11日(夏威夷時間)
研究設計:
研究採用AG方案(白蛋白紫杉醇+吉西他濱)聯合斯魯利單抗及 SBRT (ICSBRT)作為 mPDAC(轉移性胰腺導管腺癌) 的一線治療方案。經篩選合格的受試者將接受吉西他濱、白蛋白紫杉醇聯合斯魯利單抗治療,每21天為一個周期。第2周期將同步進行SBRT。白蛋白紫杉醇 125mg/m2,ivgtt,day1、8,每21天重複;吉西他濱 1000mg/m2,ivgtt,day1、8,每21天重複;斯魯利單抗 200mg,ivgtt,day1,每21天重複;SBRT :原發灶6.6Gy×5次,轉移灶 8Gy×3次,從第 2 周期開始。主要終點是 6 個月無進展生存率 (6m-PFS%)。次要終點包括總生存期(OS) 、無進展生存期(PFS) 、客觀緩解率(ORR) 、 疾病控制率(DCR) 和安全性等。
結果:
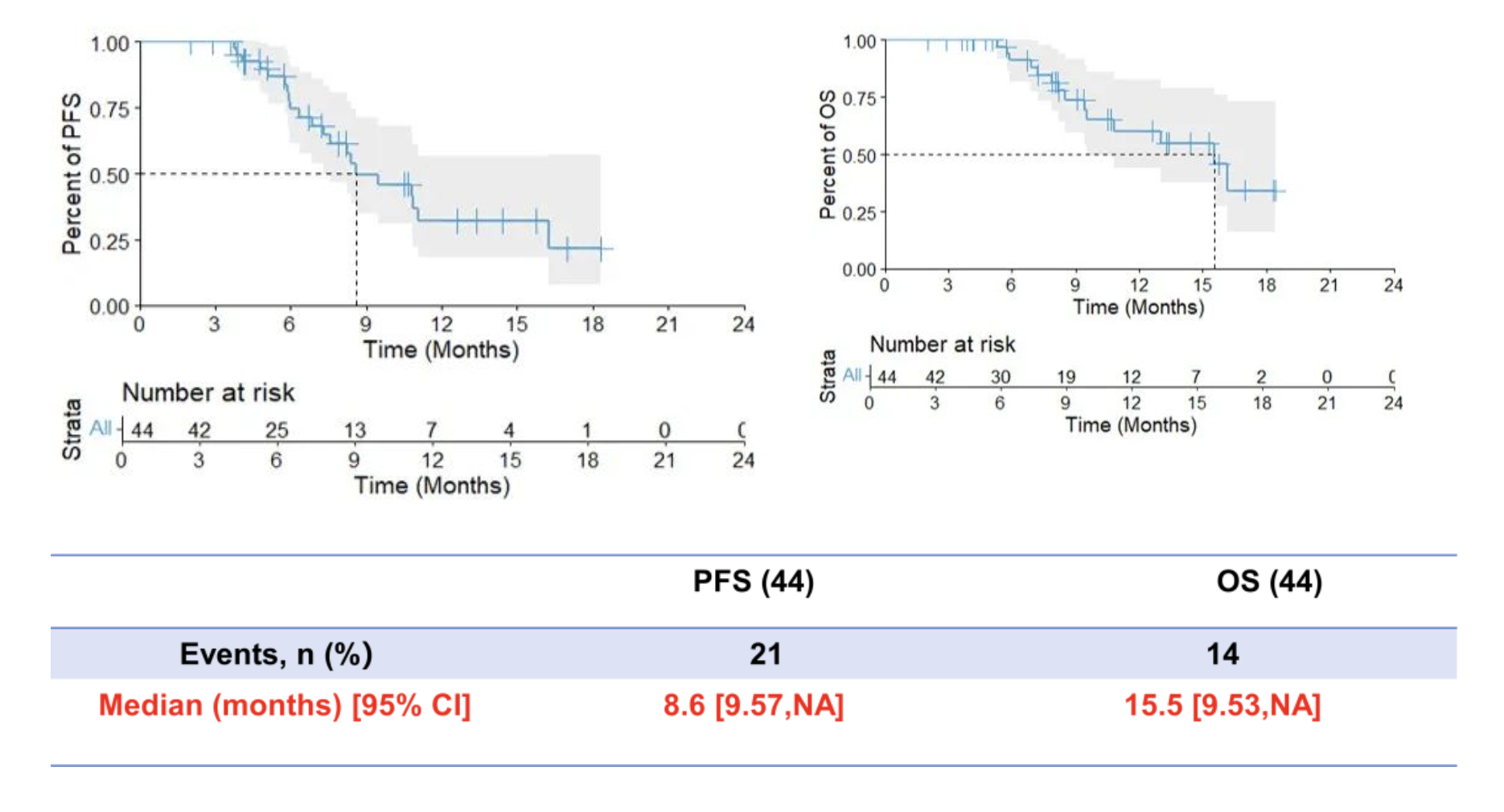
截至 2024 年10月,共納入44名患者進行分析。研究的主要終點6個月的PFS率達74.48%;次要終點mPFS為8.6個月, mOS為15.5個月。
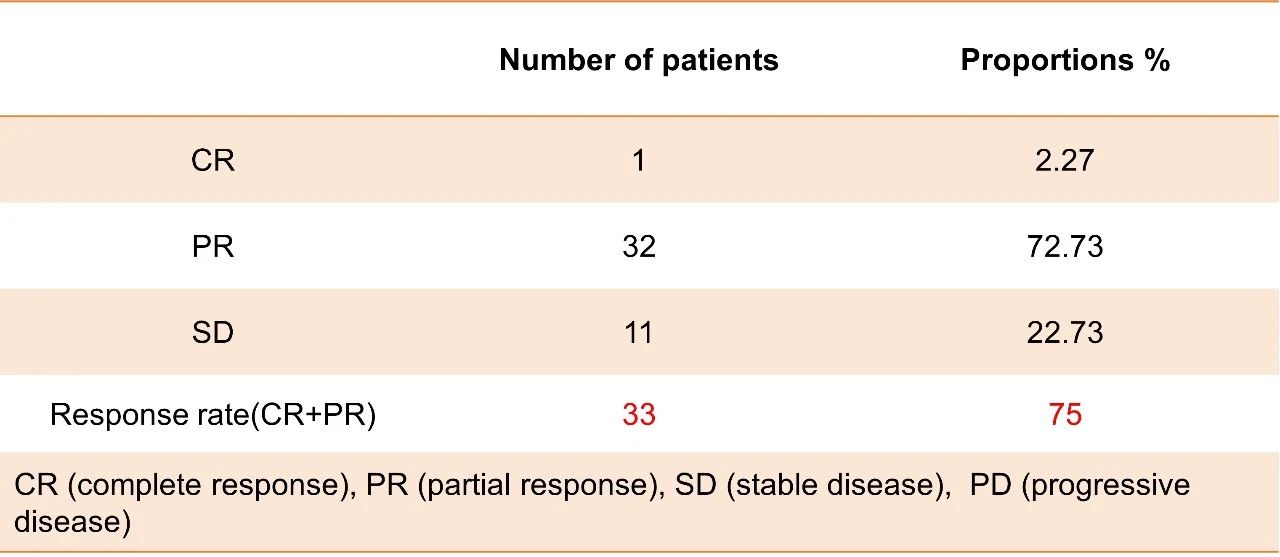
次要終點: 研究的ORR為75%,DCR為100%。
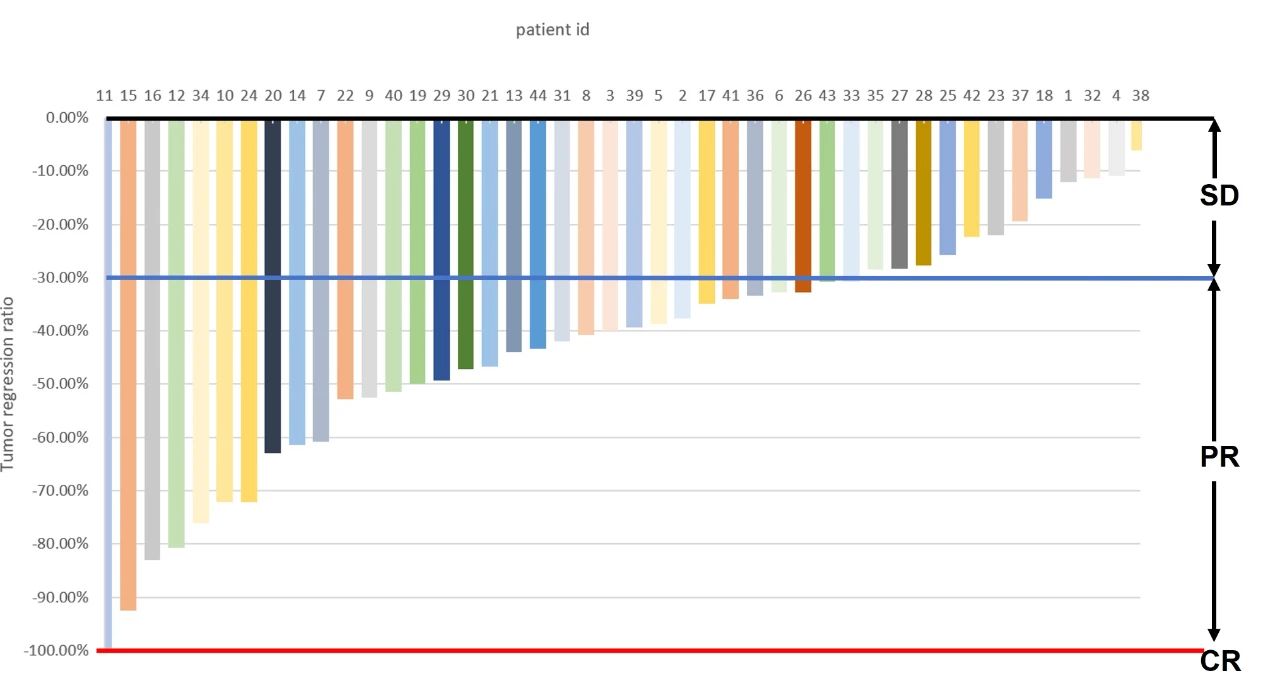
腫瘤目標病灶消退情況:N=44,所有患者在目標病灶上均出現腫瘤消退,33 例患者達到 PR/CR。
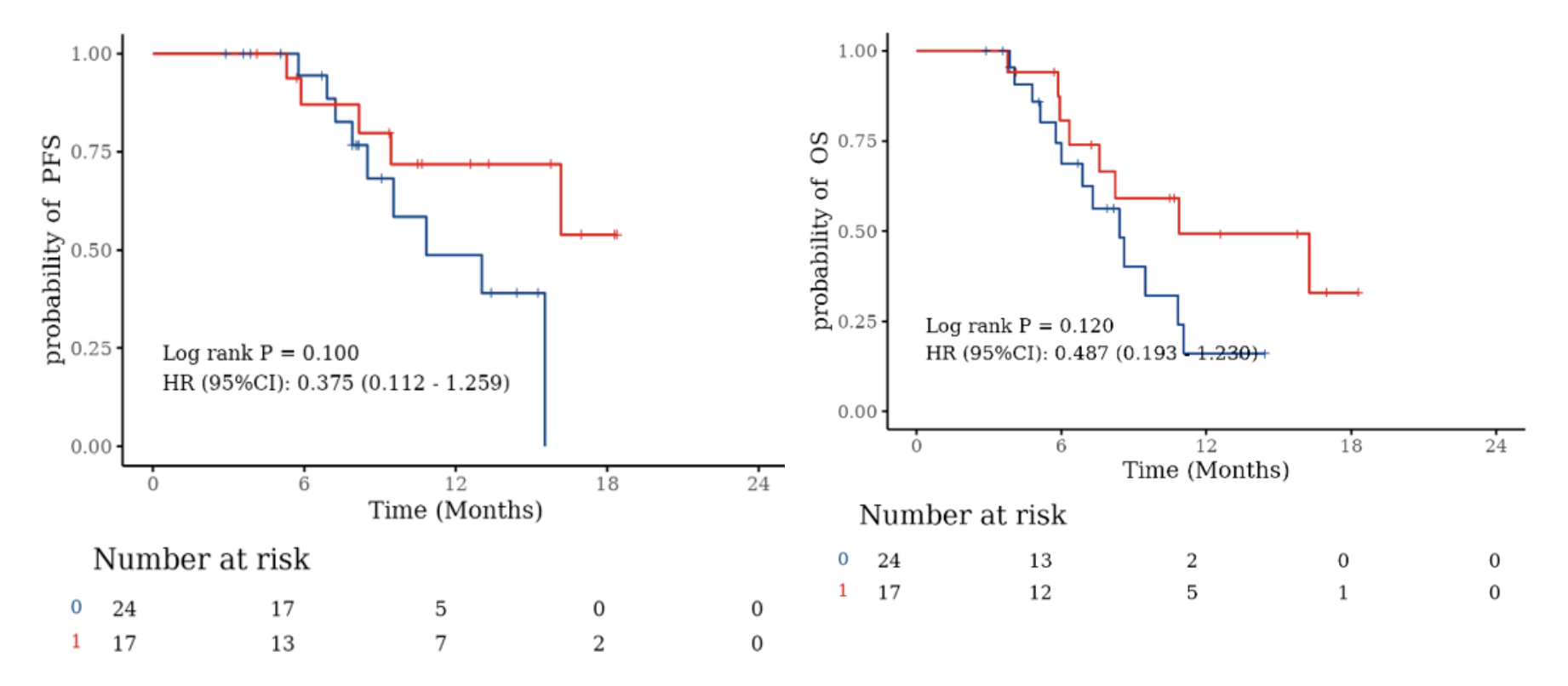
亞組生存分析:入組前是否接受過根治性切除手術,PFS和OS均無顯著性差異。
安全性分析:研究中3級以上TEAEs發生率為79.55%,沒有發生嚴重的TEAEs,常見的TEAEs為厭食,中性粒細胞減少,白細胞減少,疲勞,嘔吐,皮疹和噁心。
結論:
這項 II 期研究的中期結果達到了研究預設的主要終點,6 個月PFS率為 74.48%,ORR 為 75%,DCR 為 100%,中位 PFS 為 8.6 個月,中位 OS 為 15.5 個月,安全性可控。
這是第一個報道 ICIs 聯合 SBRT 聯合化療治療一線 mPC 的良好臨床療效和安全性的機構。免疫聯合放化療(ICSBRT)顯示出有希望的療效,這支持將這種聯合治療作為 mPDAC 患者的一線治療。
【參考文獻】[1] Bray F, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-263.
