2023年6月6日,復宏漢霖(2696.HK)宣布,公司創新型BRAFV600E小分子抑制劑HLX208用於治療BRAFV600E突變的成人朗格漢斯細胞組織細胞增生症(Langerhans cell histiocytosis,LCH)和Erdheim-Chester病(Erdheim-Chester disease,ECD)的II期臨床研究(HLX208-LCH/ECD201)結果入選2023 ASCO年會,數據以海報形式展示。該研究由中國醫學科學院北京協和醫學院附屬北京協和醫院李劍教授牽頭開展。2023年4月,HLX208被正式納入突破性治療品種名單,用於治療BRAFV600E突變的LCH和ECD。
目前ECD與LCH均被認為屬於炎性髓系腫瘤,嚴重影響患者生存質量,已被中國國家衛生健康委員會(衛健委)納入《第一批罕見病目錄》[1]。根據衛健委發布的《罕見病診療指南2019年版》[2],LCH與ECD的主要特徵為MAPK/ERK信號通路激活,均存在超過50%的BRAFV600E基因突變率,所以 BRAFV600E是這兩種罕見病的重要治療靶點。HLX208具有全新的化學母核結構,是公司從潤新生物引進的具備「同類最佳」潛力的BRAFV600E小分子抑制劑。臨床前研究結果表明,HLX208具有單一穩定晶型,良好的口服生物利用度及顯著的腫瘤抑制活性。早期臨床研究也展現出HLX208具有良好的安全性、耐受性和有效性。此次ASCO年會上公布的數據詳情如下:
論文題目
BRAFV600E抑制劑HLX208在攜帶BRAFV600E突變的朗格漢斯細胞組織細胞增生症和/或Erdheim-Chester病成年患者中的II期研究(摘要編號7574)
試驗設計
此研究是一項單臂、開放標籤、多中心的II期研究。試驗納入組織學確認的朗格漢斯細胞組織細胞增生症(LCH)和/或Erdheim-Chester(ECD)病的患者,給予每天兩次口服HLX208 450 mg。HLX208的給藥以28天為一個周期,直至疾病進展、出現不可耐受毒性、撤回知情同意、開始新的抗腫瘤治療或死亡(以先發生的為準)。試驗的主要終點是由獨立評估委員會(IRC)根據實體瘤療效PET評價標準(PERCIST)1.0評估的客觀緩解率(ORR)。次要終點包括HLX208的安全性、其他療效指標和藥代動力學特徵。
結果
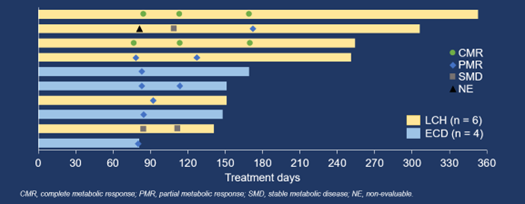
截至2023年1月15日,共22例LCH和/或ECD患者入組。所有患者都接受了至少一劑HLX208,並被納入當前的分析。中位年齡是39歲(範圍18–69)。9(40.9%)例患者為男性。12(54.5%)例患者被診斷為LCH,9(40.9%)例診斷為ECD,1(4.5%)例為LCH合併ECD。6(27.3%)例患者為單系統多病灶病變,16(72.7%)例為多系統病變。中位隨訪時間為4.8個月(95% CI 2.7–5.7)。

在10例可評估療效的患者中,IRC根據PERCIST 1.0評估的ORR(未確認)為90.0%(95% CI 55.5–99.7%)(9/10,包括2例完全代謝緩解[CMR]和7例部分代謝緩解[PMR]),由研究者根據PERCIST 1.0評估的則為100.0%(95% CI 69.2–100.0%)(10/10,包括3例CMR和7例PMR)。由IRC和研究者根據PERCIST 1.0評估的疾病控制率均為100.0%(95% CI 69.2–100.0%)。中位持續緩解時間、中位無進展生存期和中位總生存期均未達到。
22例接受了HLX208治療的患者中,17(77.3%)例報告了治療期間出現的不良事件(TEAE);12(54.5%)例報告了治療相關不良事件(TRAE),最常見的是丙氨酸氨基轉移酶升高(36.4%)、天門冬氨酸氨基轉移酶升高(22.7%)、γ-穀氨酰轉移酶升高(18.2%)和血乳酸脫氫酶升高(18.2%)。大多數TRAE為一級(27.3%)和二級(18.2%)。試驗未報告導致治療終止或死亡的TEAE。
結論
HLX208安全性和耐受性良好,對LCH和/或ECD患者顯示出良好的療效。
參考文獻
[1] 國家衛生健康委員會《關於公布第一批罕見病目錄的通知》(國衛醫發〔2018〕10號)http://www.gov.cn/zhengce/zhengceku/2018-12/31/content_5435167.htm
[2] 國家衛生健康委辦公廳《罕見病診療指南(2019年版)》(國衛辦醫函〔2019〕198號)
