北京時間2023年2月3日,復宏漢霖自主研發的抗PD-1單抗H藥 漢斯狀®(斯魯利單抗)聯合化療一線治療食管鱗狀細胞癌(ESCC)的Ⅲ期臨床研究(ASTRUM-007)結果在國際權威期刊Nature Medicine(影響因子:87.241)正式發表,該研究由國家癌症中心/國家腫瘤臨床醫學研究中心/中國醫學科學院北京協和醫學院腫瘤醫院黃鏡教授牽頭開展。

ASTRUM-007研究結果已於2022年11月在中國臨床腫瘤學會(CSCO)年會上以口頭報告亮相,並於同年12月在歐洲腫瘤內科學會亞洲年會(ESMO Asia)上進行了口頭報道。此次正式發表於Nature Medicine,再次在國際學術舞台展現了中國醫藥企業自主研製PD-1單抗的創新水平和研發實力。基於該研究結果,H藥相關適應症的上市註冊申請已經獲國家藥品監督管理局(NMPA)受理,並於近日獲得《中國食管癌放射治療指南(2022年版)》推薦與化療聯用一線治療PD-L1 CPS≥1的晚期食管鱗癌。
論文通訊作者、ASTRUM-007項目的牽頭研究者黃鏡教授表示:「ASTRUM-007研究探索了H藥聯合化療在先前未經治療的PD-L1陽性食管癌患者中的療效,H藥聯合化療組與化療組相比顯著提高了患者的PFS和OS,安全性良好。感謝所有在該研究中做出貢獻的患者、家屬和研究者的辛苦付出,期待H藥的食管鱗癌適應症早日獲批,為食管鱗癌免疫治療帶去新的選擇。」
復宏漢霖總裁朱俊表示:「H藥繼登上JAMA之後,再次榮登國際權威期刊Nature Medicine,不僅是對H藥質量的充分認可,更彰顯了公司比肩國際的臨床試驗能力和創新實力。我們在肺癌和消化道腫瘤廣泛佈局,正加速推進H藥的更多適應症上市。期待H藥作為中國創新藥的代表,以高品質的國產生物藥惠及全球更多患者。」
H藥為一線ESCC免疫治療提供新選擇
食管癌是全球範圍內十分常見的惡性腫瘤,主要分型為鱗狀細胞癌和腺癌,84%以上屬於食管鱗狀細胞癌[1]。我國是食管癌高發地區,根據2016年中國惡性腫瘤發病率及死亡率估計,我國食管癌新發病例25.3萬,死亡病例19.4萬,發病率及死亡率分別位列惡性腫瘤的第6位和第5位[2]。由於早期食管癌症狀往往不明顯,大多數患者確診時已處於臨床中晚期,失去了手術治療機會。目前臨床對晚期患者主要採用系統治療(化療或靶向治療),但治療效果有限,復發率和轉移率偏高。近年來,腫瘤免疫治療已經成為國內外研究熱點之一,多項研究表明抗PD-1單抗聯合化療可為食管癌患者帶來生存獲益,免疫檢查點抑制劑聯合化療已成為我國食管癌的一線治療標準[3]。
ASTRUM-007(NCT03958890)是一項隨機、雙盲、多中心的Ⅲ期臨床試驗,旨在研究斯魯利單抗對比安慰劑分別聯合化療在既往未接受治療、PD-L1陽性(綜合陽性評分≥1)的晚期ESCC患者中的療效和安全性。551例患者以2∶1的比例隨機分組,兩組患者分別接受斯魯利單抗或安慰劑聯合5-氟尿嘧啶和順鉑治療(每2周1次)。斯魯利單抗聯合化療組的中位無進展生存期(PFS)顯著長於安慰劑聯合化療組(5.8 vs. 5.3個月;風險比[HR] 0.60,95% CI 0.48–0.75;p<0.0001)。斯魯利單抗聯合化療組對比安慰劑聯合化療組的中位總生存期(OS)也獲得了顯著改善(15.3 vs. 11.8個月;HR 0.68,95% CI 0.53–0.87;p=0.0020)。安全性方面,斯魯利單抗聯合化療的安全性良好。與單純化療相比,斯魯利單抗聯合化療(每2周一次)作為一線治療方案顯著改善了PD-L1陽性晚期ESCC患者的PFS和OS,此治療方案為該患者群體的治療提供新選擇。
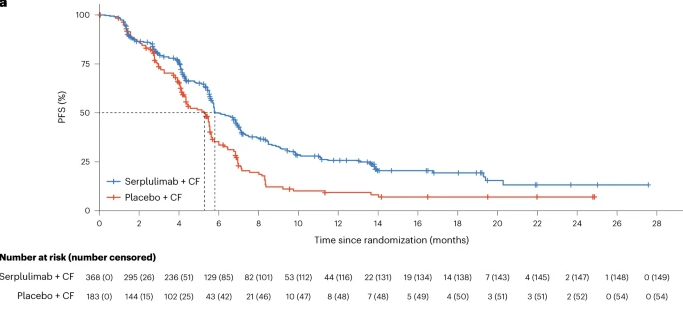
H藥聚焦大癌種,深耕肺癌及消化道腫瘤
H藥 漢斯狀®(斯魯利單抗)是復宏漢霖首個自主研製的創新型單抗藥。自2022年3月獲批上市以來,H藥已在中國獲批用於治療微衛星高度不穩定(MSI-H)實體瘤、鱗狀非小細胞肺癌和廣泛期小細胞肺癌(ES-SCLC),惠及逾15000名中國患者。以H藥為基礎,公司在全球開展多元化的腫瘤免疫聯合療法,並充分運用自有管線覆蓋腫瘤特異性靶點、抗血管生成靶點和腫瘤免疫靶點等,助力H藥與單抗、化療等治療手段開展聯合治療。以臨床需求為導向,公司就H藥在消化道腫瘤和肺癌領域進行了差異化、多維度佈局,適應症廣泛覆蓋肺癌、肝細胞癌、食管鱗癌、頭頸鱗癌和胃癌等高發大癌種,在全球範圍內累計入組逾3100名受試者。
在消化道領域,H藥已獲批的MSI-H實體瘤適應症可為MSI-H高發的結直腸癌和胃癌等患者帶去福音。此外,H藥在胃癌新輔助/輔助方面也已達到臨床研究III期,目前針對該細分領域的研究較少,公司在這一細分領域上處於國際領先地位,有望使胃癌患者在前線便從腫瘤免疫療法中獲益。在肺癌領域,H藥針對ES-SCLC適應症的ASTRUM-005研究在全球四大頂級醫學期刊之一的《美國醫學會雜誌》(JAMA,影響因子 157.3)在線發表,成為全球首個登上JAMA主刊的小細胞肺癌免疫治療臨床研究。此外,H藥已分別獲得美國食品藥品監督管理局(FDA)和歐盟委員會(EC)授予的孤兒藥資格認定,併入選《2022 CSCO小細胞肺癌診療指南》作為ES-SCLC治療推薦。
未來,復宏漢霖將持續加碼創新,以臨床需求為先導,繼續高效地為全球患者提供更多可負擔、療效更好的治療方案。
關於Nature Medicine
Nature Medicine以原創性、時效性、跨學科研究為基礎,注重對人類健康的改善,以月刊形式發表所有醫學領域的原創同行評議研究。Nature Medicine還出版新聞、綜述和展望,旨在將轉化和臨床研究的最新進展結合起來,以廣泛惠及醫學博士和博士讀者。編輯決策均由全職的專業編輯團隊做出。
關於H藥 漢斯狀®
H藥 漢斯狀®為重組人源化抗PD-1單抗注射液(通用名:斯魯利單抗注射液),是復宏漢霖首個自主研發的創新型單抗,同時為全球首個獲批一線治療小細胞肺癌的抗PD-1單抗。目前H藥有3項適應症獲批上市,1項適應症上市申請獲受理,10餘項臨床試驗同步在全球開展。
2022年3月,H藥正式獲批上市,目前可用於治療微衛星高度不穩定(MSI-H)實體瘤、鱗狀非小細胞肺癌(sqNSCLC)及廣泛期小細胞肺癌(ES-SCLC)。圍繞H藥,復宏漢霖積極推進其與公司其他產品的協同以及與創新療法的聯合,相繼獲得中國、美國、歐盟等國家及地區的臨床試驗許可,在全球同步開展12項腫瘤免疫聯合療法臨床試驗,廣泛覆蓋肺癌、食管癌、頭頸鱗癌和胃癌等適應症,全面覆蓋肺癌一線治療。截至目前,H藥已於中國、土耳其、波蘭、格魯吉亞等國家和地區累計入組超3100人,其中2項國際多中心臨床試驗入組白人的比例超過30%,是擁有國際臨床數據較多的抗PD-1單抗之一。H藥聯合化療一線治療食管鱗狀細胞癌(ESCC)的NDA也已獲得NMPA受理。此外,H藥分別被《2022 CSCO小細胞肺癌診療指南》、《中國食管癌放射治療指南(2022年版)》納入ES-SCLC和晚期食管鱗癌的一線治療推薦。針對ES-SCLC的國際多中心臨床研究ASTRUM-005成為全球首個登上JAMA的小細胞肺癌免疫治療臨床研究,同時食管鱗狀細胞癌(ESCC)相關研究ASTRUM-007的成果也榮登國際期刊Nature Medicine。另外,H藥治療SCLC已獲得美國FDA和歐盟EC的孤兒藥資格認定,並在美國啟動了一項H藥對比一線標準治療阿替利珠單抗的頭對頭橋接試驗。
參考文獻
[1] Arnold, M., Ferlay, J., van Berge Henegouwen, M.I. & Soerjomataram, I. Global burden of oesophageal and gastric cancer by histology and subsite in 2018. Gut 69, 1564-1571 (2020).
[2] Zheng, R., Zhang, S., Zeng, H., et al. Cancer incidence and mortality in China, 2016. Journal of the National Cancer Center 2, 1-9 (2022).
[3] 食管癌診療指南(2022年版). 中國國家衛生健康委員會.
*圖片素材來源於Nature Medicine官網
