兩年前就有專家預言,「再過5年,在臨床上預計會有80多家企業在做PD-(L)1,那時候不是用它來打針,是用來洗澡了。」雖然這是一句玩笑話,但也透露出國內PD-(L)1產品研發同質化的殘酷。
2022年3月25日,復宏漢霖(2696.HK)宣佈,旗下首款自主研發的創新生物藥PD-1抑制劑H藥——漢斯狀®(通用名:斯魯利單抗注射液)正式獲得國家藥監局批准,用於經既往標準治療失敗的、不可切除或轉移性微衛星高度不穩定(MSI-H)的成人晚期實體瘤適應症。
斯魯利單抗是復宏漢霖首款自主研發的創新型單抗,業內俗稱為「H藥」。隨着復宏漢霖的斯魯利單抗獲批上市,截至目前,國內已獲批的PD-(L)1單抗一共有13款,其中,國產PD-1單抗一共有7款。
在國內外審批政策越來越吃緊的當下,復宏漢霖PD-1以何突圍?競品越來越多,價格內卷...一片紅海里,復宏漢霖選擇了一條怎樣的創新之路,又將如何走出同質化怪圈?值得關注。
另闢蹊徑—— MSI-H實體瘤:細分賽道「藍海」
據統計,目前在中國進入臨床階段的PD-(L)1藥品及候選藥品有70個。國金證券指出,從適應症上看,大部分產品都採取了「小瘤種上市+擴展大瘤種」的策略。霍奇金淋巴瘤和黑色素瘤是常見的兩個首先上市的小瘤種。
目前市面上的PD-(L)1產品已經有多項適應症獲批,覆蓋了在中國患者人群較大的肺癌、肝癌、食管癌等適應症。
如何爭取優勢,在當前的PD-1紅海市場中突圍?後上市的PD-1產品只能尋求差異化發展,或者是在臨床數據上有更為優異的表現。
此次復宏漢霖的斯魯利單抗獲批上市的MSI-H實體瘤適應症,不以癌種進行區分,能夠覆蓋子宮內膜癌、結直腸癌、胃癌、腎細胞癌、卵巢癌等幾十種實體瘤。
在這適應症上,復宏漢霖也一直是先行者。早在臨床前及早期臨床研究中,H藥便交出了優異的PK、PD數據,並在其關鍵性II期臨床試驗中展現出良好的抗腫瘤活性和較好的安全性,顯著延長了患者的生存期。相關研究數據首次在2021年CSCO年會上發佈。
該產品臨床前研究及結構特徵研究已發表於國際期刊PLOS ONE,研究結果顯示,與Nivolumab和Pembrolizumab相比,H藥在體外和體內顯示出相似或更好的生物活性,且與貝伐珠單抗漢貝泰(HLX04)聯用有協同抗腫瘤作用。通過對H藥Fab段與PD-1胞外區結合複合物的結構解析,該產品具有區別於Pembrolizumab和Nivolumab的獨特識別模式,並與Pembrolizumab有相近的結合表位。
斯魯利單抗在經治療、不可切除或轉移性高度微衛星不穩定或錯配修復缺陷(MSI-H/dMMR)實體瘤中開展的II期臨床試驗,在主要療效分析人群中,經IRRC評估的ORR為39.7%(95%CI:28.03,52.30; 3例完全緩解,24例部分緩解)。研究結果表明,H藥單藥治療既往標準治療失敗的、不可切除或轉移性MSI-H實體瘤獲益顯著,達到預設的主要終點標準,且具有良好的安全性和耐受性。
資料顯示,MSI-H實體瘤是指一類具有微衛星高度不穩定表型的實體瘤,最早在遺傳性結直腸癌中被發現,後來研究發現,MSI-H普遍存在於其他癌症類型患者中,包括子宮內膜癌、胃癌、肝細胞癌、黑色素瘤等癌細胞。有研究顯示,MSI-H在所有癌種中的發生率約為14%,該類患者通常對於免疫檢查點抑制劑有較高的應答率。由於不依據病灶部位而參考腫瘤標誌物檢測進行劃分,變相增加了產品的開發難度。
根據我國各腫瘤發病率及MSI-H各腫瘤發生率測算,國內每年新發MSI-H的實體瘤患者約為30多萬人。PD-1賽道熱門適應症競爭激烈,然而仍有眾多細分適應症尚未覆蓋,像MSI-H實體瘤,臨床需求迫切,市場規模可觀。
截至目前,國內僅有兩款PD-1單抗是獲批適用於MSI-H實體瘤。除了復宏漢霖H藥,還有一款是百濟神州的PD-1單抗百澤安,後者於今年3月11日獲批這一新適應症。國內MSI-H實體瘤領域仍然處於藍海,尚待開發。
復宏漢霖董事長、執行董事兼行政總裁張文杰表示,希望大家共同開發這個藍海市場,並對公司產品的臨床數據充滿信心。此外,公司的商業化團隊也已準備就緒,將全力加速推進H藥的各項商業化進程。據了解,在商業化運營上,復宏漢霖已於2022年第一季度組建完成約200人的銷售團隊,產品上市後將迅速落實差異化佈局並全面滲透中國市場。在積極落實市場推廣和銷售佈局的同時,其也將計劃與基因檢測公司建立深入合作關係,共同在腫瘤領域不斷探索創新解決方案,構建新型患者服務模式,提升MSI檢測標準及可及性,逐步建立圍繞消化道腫瘤、婦科腫瘤的患者診療生態圈。
在此基礎上,隨着斯魯利單抗其他適應症(包括sqNSCLC、ES-SCLC等)之後的陸續獲批,復宏漢霖也將進一步夯實肺癌等領域的市場銷售佈局,有序搭建完整的腫瘤患者診療生態系統。
持續擴大差異化 深耕SCLC等領域
除了首個獲批上市的MSI-H實體瘤適應症,H藥的未來也極其可期。
復宏漢霖總裁朱俊在接受媒體採訪時表示,雖然目前國內PD-1總體競爭激烈,但臨床數據差異大,有些細分賽道仍是藍海。
尤其值得一提的是,斯魯利單抗聯合化療在既往未接受過治療的廣泛期小細胞肺癌(ES-SCLC)的國際多中心III期研究已於去年12月達到主要終點。
研究結果顯示,斯魯利單抗聯合卡鉑-依託泊苷在總體人群和中國亞組均可延長中位總生存期(OS),斯魯利單抗組和安慰劑組的總人群中位OS分別為15.38個月和11.10個月,總人群降低死亡風險達38%(中國亞組達41%),p <0.001,兩個給藥組的2年總生存率(OSR)分別為43.2%和8.0%,且具有良好的安全性。
復宏漢霖計劃於2022年在中國及歐盟遞交該適應症的上市註冊申請,如果獲批成功,復宏漢霖的H藥有望成為全球首個一線治療SCLC的抗PD-1單抗。
公開資料顯示,小細胞肺癌約佔支氣管源性肺癌的15%-20%,小細胞肺癌確診時,腫瘤處於局限期的患者約佔30%,其餘處於廣泛期,當腫瘤擴散到鎖骨上區以外時即為廣泛期。由於小細胞肺癌確診時腫瘤很可能已經廣泛擴散,小細胞肺癌往往很難治癒。業內稱之為其是歷來以複雜難懂的腫瘤發生發展機制、短暫的生存期和微乎其微的治療進展的疾病。
目前全球僅有兩款PD-L1單抗獲批一線治療SCLC,斯魯利單抗是首個在SCLC一線適應症上取得III期陽性結果的PD-1單抗。此前,兩款PD-1單抗——百時美施貴寶的O藥、默沙東的K藥,都因為確證性試驗的陰性OS結果,而陸續撤銷了該適應症的上市申請。
小細胞肺癌新藥開發道路漫長且崎嶇,復宏漢霖選擇了「明知山有虎,偏向虎山行」,如今H藥國際多中心III期達到了OS的主要研究終點,也給PD-1單抗在這一領域注入了信心。並且,同已獲批的PD-L1數據相比,復宏漢霖的H藥也有一定的優勢。對比公開的臨床數據,PD-L1在治療SCLC中只有22.9%的人能活過兩年,而H藥可以將兩年生存率翻一倍。
2020年全球癌症統計報告顯示,中國約有超過81萬新發肺癌病例,其中約12萬是小細胞肺癌。同「九死一生」的研發現狀相比,小細胞肺癌的市場空間很大。
另外,復宏漢霖H藥的其它適應症也迎來了重要進展。2021年9月,斯魯利單抗聯合化療在局部晚期或轉移性鱗狀非小細胞肺癌(sqNSCLC)的NDA獲得NMPA受理;H藥聯合化療一線治療食管鱗癌(ESCC)的上市註冊申請也有望於2022年遞交。
積極探索聯合療法 放眼全球市場
各大藥企之所以扎堆研發PD-(L)1產品,因為它不僅僅是廣譜抗癌藥,可以治療很多種癌症,而且還是免疫療法的基石藥物,可以與多種藥物聯合使用發揮出1+1>2的效果。
據了解,除了不斷覆蓋更多適應症尤其是關鍵大瘤種外,復宏漢霖還在積極探索聯合療法,為患者提供更優的治療解決方案。目前H藥已獲得中國、美國、歐盟等國家及地區的臨床試驗許可,同步開展9項聯合治療方案,適應症全面覆蓋肺癌、胃癌、食管癌、頭頸癌等全球及中國高發瘤種。
復宏漢霖H藥產品進展
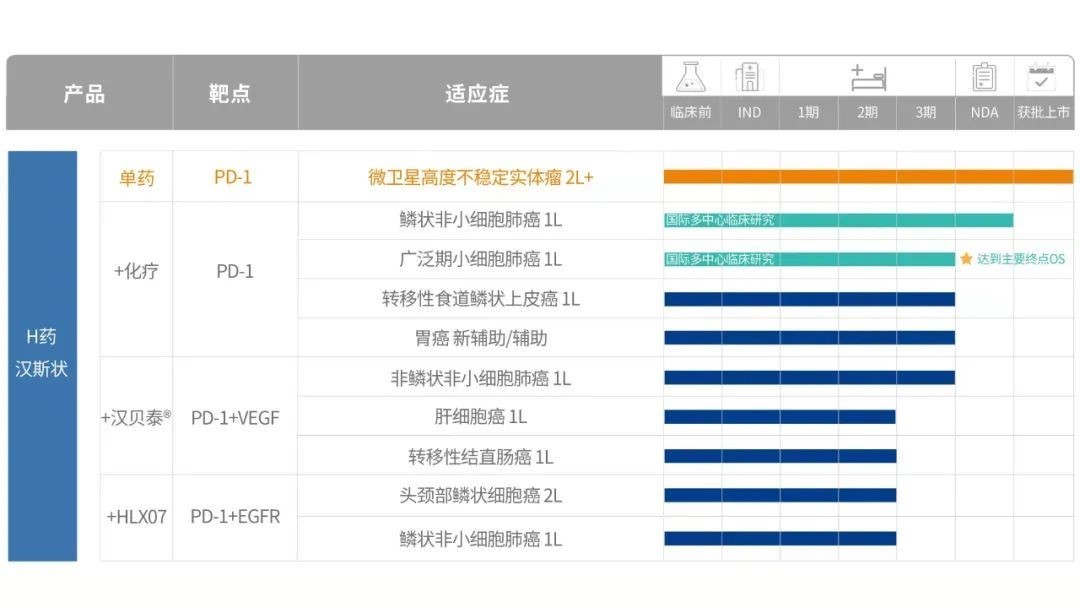
其中,在肺癌領域,復宏漢霖現已實現一線的全面臨床佈局,在局部晚期或轉移性鱗狀非小細胞肺癌(sqNSCLC)、非鱗狀非小細胞肺癌(nsNSCLC)和小細胞肺癌(SCLC)均就H藥開展試驗,覆蓋了超過90%的肺癌患者。復宏漢霖針對sqNSCLC和SCLC兩項適應症均開展了國際多中心Ⅲ期臨床試驗,超30%的海外人種入組。
國內市場競爭白熱化,PD-(L)1企業尋求海外機會也是各公司戰略佈局當中的重要一環。同時,走出國門,獲得國際市場的認可,也更加能說明這一產品的創新性。
據悉,該藥已於全球範圍內累計入組超過2800名受試者。豐富的國際臨床數據可以為H藥的海外申報奠定了基礎,以及進行後續商業化。
此外,早在2019年,復宏漢霖就與PT Kalbe Genexine Biologics(KG Bio)達成合作,授予其H藥首個單藥療法及兩項聯合療法在東南亞地區10個國家的獨家開發和商業化權利,並將根據H藥的臨床和獲批進展,持續海外商業拓展以覆蓋更多國家和地區,以優質生物藥,惠及更多全球病患。
另一邊,作為國內較早實現自研產品海外上市的生物製藥公司,復宏漢霖已通過漢曲優這一「先頭部隊」鍛煉出了出海所需要的一體化能力,逐步建立起了自己完善的研發、生產、商業化體系。這也能為公司後續H藥等創新產品「出海」打下了紮實的基礎,並積累了寶貴的經驗。
後記
自2018年12月第一款國產PD-1獲批上市,前後不過3年多時間,PD-(L)1市場已經迎來了十餘款產品,一些變化也在悄然發生。
隨着上市產品越來越多,還有多款PD-(L)1正在排隊等待獲批上市;2019年醫保介入,三年間國內PD-(L)1價格逐漸「普藥化」;另外,2021年CDE發佈抗腫瘤藥新政,進一步打擊偽創新、me-worse藥物……國內的競爭熱潮使得PD-1出海成為新的突圍點,然而FDA的審評審批也在收緊,具有差異化、療效更優異的產品才能脫穎而出。
可以看到,不管是定價方面,還是國內外審批政策等等,國產PD-(L)1都面臨着較大的競爭壓力。在這當中,如何在競爭中突圍,如何尋找差異化發展,如何真正解決臨床痛點,滿足未被滿足的臨床需求是當下PD-(L)1研發藥企能否實現突破與化繭成蝶的關鍵。
*圖片素材來源於活動第三方
