2020年歐洲腫瘤學會亞洲分會(ESMO Asia年會)於11月20日至22日召開,此次ESMO Asia年會採取線上會議形式。會上,復宏漢霖自主開發的貝伐珠單抗HLX04(重組抗VEGF人源化單克隆抗體注射液)在中國結直腸癌患者中的3期臨床研究HLX04-mCRC03數據以電子海報的形式發佈,該研究的主要研究者為東部戰區總醫院秦淮醫療區秦叔逵教授和上海同濟大學附屬東方醫院李進教授。
以下為本次數據發佈的詳細信息:
論文題目:一項比較HLX04或貝伐珠單抗參照葯聯合奧沙利鉑或氟尿嘧啶類(XELOX或mFOLFOX6)一線治療轉移性結直腸癌的安全性、有效性的隨機、雙盲的3期臨床試驗
發佈形式:電子海報
海報編號:104P
講者:秦叔逵教授,東部戰區總醫院秦淮醫療區
展示時間:2020.11.19 12:00(北京時間)—2020.11.29 24:00(北京時間)
HLX04是復宏漢霖以原研貝伐珠單抗為參照葯、按照國家《生物類似葯研發與評價技術指導原則(試行)》自主開發的生物類似葯。目前,該產品的上市註冊申請(NDA)已正式獲得國家藥品監督管理局(NMPA)受理,有望用於晚期、轉移性或複發性非小細胞肺癌以及轉移性結直腸癌患者的治療。區別於目前國內已上市的貝伐珠單抗生物類似葯,HLX04在臨床有效性、安全性3期比對研究的設計上選擇了轉移性結直腸癌為適應症,是目前國內唯一擁有轉移性結直腸癌臨床試驗數據的貝伐珠單抗生物類似葯,可為貝伐珠單抗在中國結直腸癌患者人群中的應用積累更多臨床證據與經驗。同時,這項3期臨床研究數據也為HLX04與公司自有抗PD-1單抗HLX10組成免疫聯合療法提供了有力支持。值得一提的是,HLX10與HLX04的聯合治療方案為國內首個獲得臨床試驗申請批准的國產單抗聯合療法,目前HLX04聯合HLX10已在非鱗狀非小細胞肺癌、肝細胞癌等多種實體瘤中開展多項臨床研究,其中針對一線非鱗狀非小細胞肺癌的臨床試驗已進入關鍵臨床3期。
為發揮VEGF抑製劑在眼部疾病治療中的潛力,惠及更多患者,復宏漢霖針對HLX04進行差異化開發,新增原研貝伐珠單抗尚未覆蓋的濕性年齡相關性黃斑變性、糖尿病性視網膜病變兩項眼科適應症,目前已獲得國家葯監局臨床試驗批准。同時,復宏漢霖攜手合作夥伴億勝生物共同開發HLX04治療濕性年齡相關性黃斑變性(wAMD)等眼科適應症,充分發揮雙方在產品研發和眼科藥品全球商業化方面的優勢。目前,復宏漢霖已就HLX04適用於眼科疾病而全新開發的安全、穩定的製劑配方提交了專利申請。
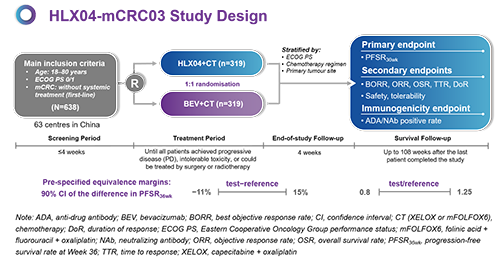
試驗設計
HLX04-mCRC03是一項多中心、隨機、雙盲、平行對照的3期臨床試驗(臨床試驗號:NCT03511963),旨在比較HLX04或參照貝伐珠單抗聯合化療方案(XELOX方案或mFOLFOX6方案)一線治療轉移性結直腸癌的療效、安全性和免疫原性。納入的患者按照1:1的比例隨機分為兩組,分別靜脈注射HLX04或原研貝伐珠單抗(聯合XELOX時每三周注射一次,劑量為7.5 mg/kg,聯合mFOLFOX6時每兩周注射一次,劑量為5 mg/kg)。主要療效終點為36周的無進展生存率(PFSR36wk)。
試驗結果
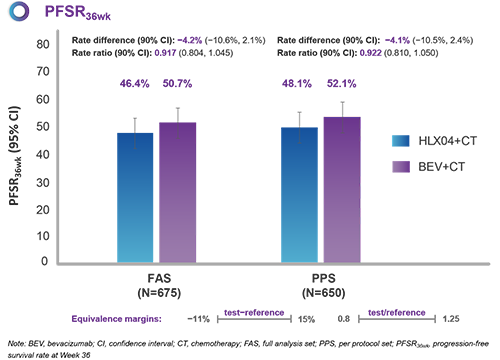
· 有效性-主要終點
本試驗入組了675例病患(HLX04組,N=338;原研組,N=337)。在全分析集(FAS)中,HLX04組和原研組的PFSR36wk分別為46.4%和50.7%。兩組率差為−4.2%(90%置信區間:−10.6%,2.1%),落於預先設定的等效界值(−11%,15%)範圍之內,證明HLX04和原研貝伐珠單抗的療效相似性。
· 有效性-次要終點
兩治療組的次要療效終點如總生存期(OS)、無進展生存期(PFS)、客觀緩解率(ORR)、至緩解時間(TTR)、緩解持續時間(DoR)等,均無統計學差異(p>0.05)。
· 安全性及免疫原性
HLX04和原研貝伐珠單抗的安全性和免疫原性特徵相似。
結論
3期臨床試驗結果顯示,HLX04與原研貝伐珠單抗在一線治療轉移性結直腸癌患者時,療效、安全性和免疫原性特徵相當。HLX04作為生物類似葯候選葯將為癌症患者帶來更多治療選擇。
