2020年5月27日,復宏漢霖(香港聯交所代碼:2696)今日宣布,公司自主研製的Denosumab生物類似葯HLX14(重組抗RANKL全人單克隆抗體注射液)正式獲得國家藥品監督管理局(NMPA)臨床試驗批准,適應症為高危骨折風險的女性絕經後骨質疏鬆症。
作為全球骨質疏鬆症患者最多的國家,中國擁有超過1億的骨質疏鬆症患者,且集中分佈於絕經後婦女及老年人群[1]。研究表明,骨質疏鬆症易導致骨折等一系列健康問題,嚴重影響着人們的生活質量。目前,全球範圍內骨質疏鬆症就診率和規範化治療率尚且較低,隨着患者人群的持續增長,骨質疏鬆症患者的巨大治療需求亟待滿足[2]。
RANKL(receptor activator of nuclear factor kappa B ligand,NF-κB受體活化因子配體)屬於腫瘤壞死因子(tumour necrosis factor, TNF)配體超家族成員,在骨吸收的調控中發揮關鍵作用。通過特異性地結合RANKL,HLX14可阻斷RANKL與破骨細胞表面的NF-κB受體活化因子(RANK)結合,阻止RANKL/RANK介導的破骨細胞的分化、成熟及活化,進而減少骨吸收,增加患者骨密度,降低患者骨折的風險[3]。
RANKL(receptor activator of nuclear factor kappa B ligand,NF-κB受體活化因子配體)屬於腫瘤壞死因子(tumour necrosis factor, TNF)配體超家族成員,在骨吸收的調控中發揮關鍵作用。通過特異性地結合RANKL,HLX14可阻斷RANKL與破骨細胞表面的NF-κB受體活化因子(RANK)結合,阻止RANKL/RANK介導的破骨細胞的分化、成熟及活化,進而減少骨吸收,增加患者骨密度,降低患者骨折的風險[3]。
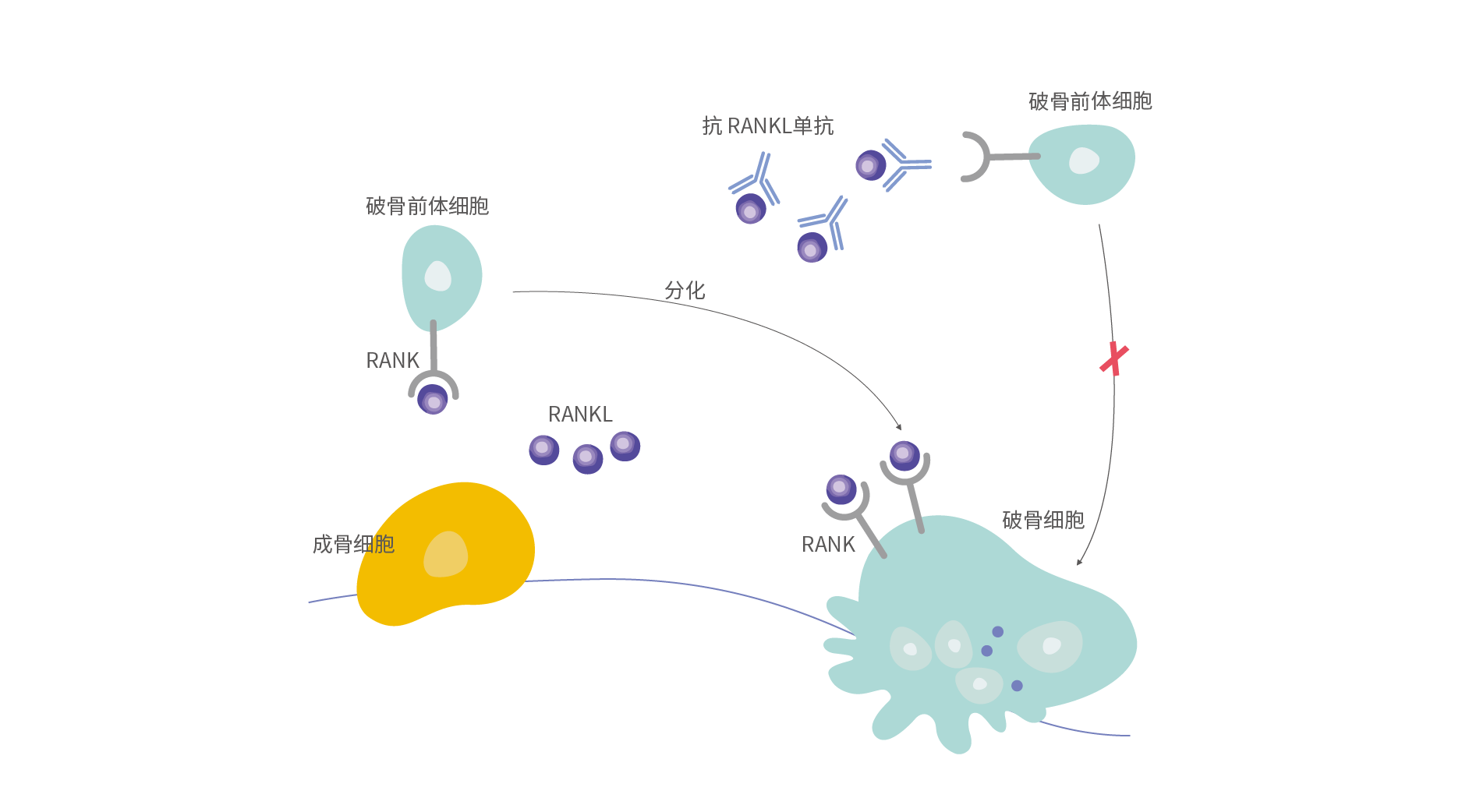
抗RANKL單抗作用機制示意圖
參照國家藥品監督管理局藥品審評中心(CDE) 發佈的《生物類似葯研發與評價技術指導原則(試行)》以及 歐洲藥品管理局(EMA)發佈的「Guideline on Similar Biological Medicinal Products」的要求,復宏漢霖遵循逐步遞進、比對及相似性評價原則,對 HLX14與原研葯Denosumab (英文商品名:Prolia®)進行了頭對頭比較。研究結果表明,HLX14與原研葯在臨床前藥理學、毒理學及葯代動力學方面皆高度相似,有望為高骨折風險的骨質疏鬆症患者帶來新的質高價優的選擇。
復宏漢霖前瞻性布局了一個多元化、高質量的產品管線,覆蓋了多個可在近期實現商業化的候選單抗生物類似葯。2019年2月中國首款生物類似葯漢利康®獲批之後,復宏漢霖另外兩款重磅產品HLX03(阿達木單抗注射液)與HLX02(注射用曲妥珠單抗)的新葯上市申請已先後獲國家葯監局受理並納入優先審評程序,有望於今年上市。HLX14的開發將有助於進一步拓展復宏漢霖豐富的產品管線,更是拓寬公司疾病領域布局的積極探索。
此外,復宏漢霖在生物創新葯和聯合療法均有積極布局,在全球多地快速推進創新產品臨床研究的同時,積極打造多元化的、基於自有產品(以抗PD-1/PD-L1單抗等為核心)的聯合療法組合。未來,復宏漢霖將持續引領創新生物葯的開發,憑藉已經建立起的完善的創新研發平台,持續高效地為全球患者提供可負擔的、療效更好的治療方案。
復宏漢霖前瞻性布局了一個多元化、高質量的產品管線,覆蓋了多個可在近期實現商業化的候選單抗生物類似葯。2019年2月中國首款生物類似葯漢利康®獲批之後,復宏漢霖另外兩款重磅產品HLX03(阿達木單抗注射液)與HLX02(注射用曲妥珠單抗)的新葯上市申請已先後獲國家葯監局受理並納入優先審評程序,有望於今年上市。HLX14的開發將有助於進一步拓展復宏漢霖豐富的產品管線,更是拓寬公司疾病領域布局的積極探索。
此外,復宏漢霖在生物創新葯和聯合療法均有積極布局,在全球多地快速推進創新產品臨床研究的同時,積極打造多元化的、基於自有產品(以抗PD-1/PD-L1單抗等為核心)的聯合療法組合。未來,復宏漢霖將持續引領創新生物葯的開發,憑藉已經建立起的完善的創新研發平台,持續高效地為全球患者提供可負擔的、療效更好的治療方案。
