9月19日,復宏漢霖參與了第22屆全國臨床腫瘤學大會暨2019年CSCO學術年會,其自主研發的創新型全人源化重組抗EGFR單抗——HLX07在晚期實體瘤中評價其安全性的1期臨床試驗(NCT02648490)最新階段性數據已由侯明模醫師進行了壁報展示,具體展示信息如下:

以下為本次數據發佈的詳細信息:
研究背景與目的
HLX07通過作用於EGFR靶點發揮其腫瘤抑制作用,臨床前研究顯示相較於國內已獲批的EGFR抑製劑西妥昔單抗,改良了其抗體結合片段(Fab)的HLX07具有更好的免疫原性及更強的抗體結合能力。臨床前動物研究表明,與相同劑量的西妥昔單抗相比,HLX07具有更好的抗腫瘤活性和更低的毒性。
HLX07 的1期臨床試驗旨在評價HLX07在晚期實體瘤患者中的安全性、耐受性和初步療效,計劃獲得可支持其開展1b/2期臨床試驗的有效數據,以驗證HLX07聯合化療在晚期實體瘤患者中的安全性和有效性。
研究方案
該試驗在中國台灣開展,為一項評價不同劑量(50、100、200、400、600、800mg)的HLX07在晚期實體瘤患者中的安全性、耐受性、葯代動力學特性和初步療效的開放性1期試驗。試驗採用傳統的3+3劑量遞增的設計方案, 每個劑量至少入組3例受試者。入組後,患者每周靜脈輸注HLX07直至疾病進展、撤回同意或死亡,以先發生者為準。我們將觀測HLX07平均血葯濃度與劑量的關係;在研究期間評估其安全性,並根據國家中心研究所(NCI)不良事件的共同術語標準(CTCAE)4.0對不良事件進行分級;每8周通過計算機斷層掃描(CT)或磁共振成像(MRI)評估一次臨床療效。
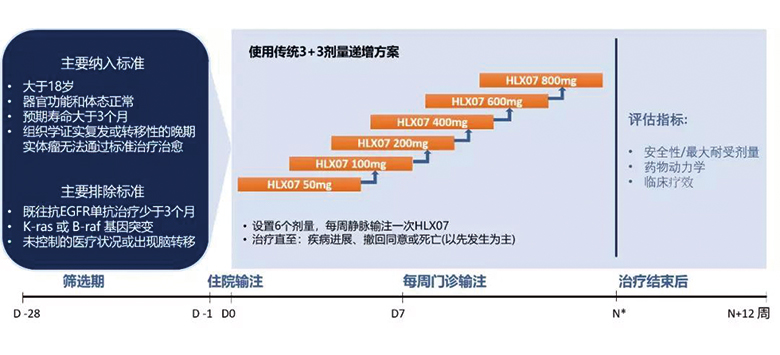
研究結果
該試驗共入組患者19例,中位年齡為58歲,其中男性患者佔84.2%。
有效性結果
在17例可評估的患者中,觀測到1例部分緩解,5例疾病穩定。
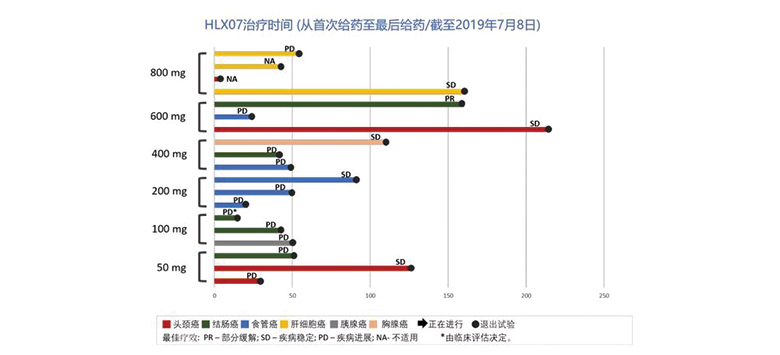
安全性結果
HLX07顯示出良好的安全耐受性。6個劑量組中均未發現明顯的、超出預期的不良反應(AE)。直至最高劑量組(800mg),試驗中未出現劑量限制性毒性,未達到最大耐受劑量(MTD)。
結論
試驗結果顯示HLX07安全性數據良好,直至最高劑量組(800mg)都未達到MTD。HLX07的1期試驗顯示的良好安全性和初步療效完全可以支持其開展1b/2期臨床試驗,以驗證HLX07聯合化療在晚期實體瘤患者中的安全性和有效性。現HLX07的1b/2期臨床試驗已在國內啟動,其與HLX10(重組抗PD-1人源化單克隆抗體注射液)聯合應用於頭頸部鱗狀細胞癌的臨床研究已獲得國家藥品監督管理局臨床試驗註冊審評受理。
