H药 汉斯状®为复宏汉霖自主研发的重组人源化抗PD-1单抗注射液,也是全球首个获批一线治疗小细胞肺癌的抗PD-1单抗,已在中国和多个东南亚国家获批上市。以临床需求为导向,公司围绕H药进行了差异化、多维度的适应症布局,广泛覆盖肺癌、消化道肿瘤等高发大癌种。截至目前,H药已在中国获批用于治疗鳞状非小细胞肺癌(sqNSCLC)、广泛期小细胞肺癌(ES-SCLC)、食管鳞状细胞癌(ESCC)和非鳞状非小细胞肺癌(nsNSCLC),惠及患者超过90,000人。此外,公司亦积极推进H药在更多差异化适应症中的创新联合疗法,探索在结直肠癌、胃癌和局限期小细胞肺癌(LS-SCLC)等领域的应用,为更多患者带去治疗希望。
HLX22为复宏汉霖自AbClon, Inc.许可引进、并后续自主研发的靶向HER2的创新型单克隆抗体。临床前研究表明,HLX22与曲妥珠单抗联合治疗能够协同抑制肿瘤细胞增殖和诱导细胞凋亡,在体内和体外均表现出增强的抗肿瘤活性。HLX22联合曲妥珠单抗及化疗一线治疗HER2阳性胃/胃食管交界部(G/GEJ)癌的II期临床研究结果显示,在曲妥珠单抗联用化疗的基础上加入HLX22可明显改善HER2阳性G/GEJ癌患者一线治疗的效果,且安全性可控[1,2]。目前,HLX22联合曲妥珠单抗和化疗一线治疗HER2阳性晚期G/GEJ的国际多中心III期临床试验相继获中国、美国、日本、澳大利亚临床试验许可,并于中国完成首例患者给药。
本次ASCO GI大会上发布的研究数据详情如下:
H药 汉斯状®
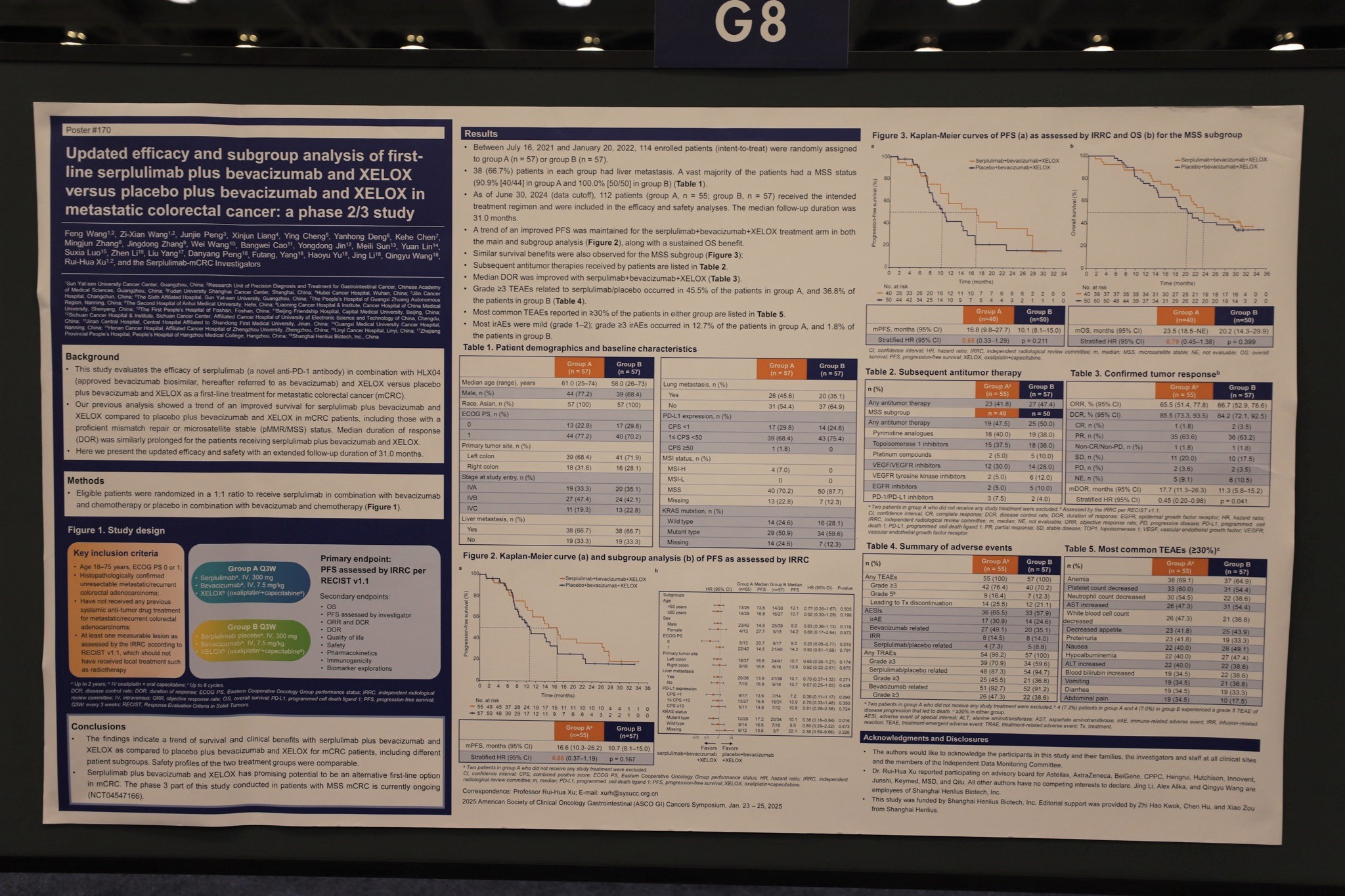
论文题目:斯鲁利单抗联合贝伐珠单抗和XELOX对比安慰剂联合贝伐珠单抗和XELOX一线治疗转移性结直肠癌的疗效和亚组分析更新:一项II/III期研究
试验设计:共有114名未接受过系统治疗的mCRC患者以1:1的比例随机分配至斯鲁利单抗治疗组(n = 57)或安慰剂治疗组(n = 57)。两组患者分别接受斯鲁利单抗(300 mg)联合贝伐珠单抗(7.5 mg/kg)和XELOX(A组)或安慰剂联合贝伐珠单抗和XELOX(B组),每3周一次。分层因素包括PD-L1表达水平、ECOG PS评分和原发肿瘤部位。主要终点是由独立影像学评审委员会(IRRC)根据RECIST 1.1评估的无进展生存期(PFS)。次要终点包括其他有效性终点、安全性、药代动力学、生物标志物探索和生活质量评估。
结果:2期研究部分,截至数据截止日期2024年6月30日,在改良的意向治疗人群(n = 112;A组中有两例患者未接受任何研究治疗)中,与B组相比,在A组中观察到PFS(16.6m vs. 10.7m,HR 0.66,95%Cl 0.37–1.19)和DOR(17.7m vs. 11.3m,HR 0.45,95% Cl 0.20–0.98)的持续改善。在微卫星稳定型(MSS)患者中也观察到了类似的PFS和OS获益趋势(PFS:16.8m vs. 10.1m,HR 0.65,95% Cl 0.33–1.29;OS:23.5m vs. 20.2m,HR 0.79,95% Cl 0.45–1.38)。大多数irAEs为轻度(1-2级);A组中12.7%的患者发生了≥3级的irAEs;B组中有1.8%的患者发生了≥3级的irAEs。
结论:中位随访时间为31.0个月时,在贝伐珠单抗和XELOX基础上加入斯鲁利单抗一线治疗mCRC患者(包括MSS患者)展现了生存获益,并维持了可控的安全性特征。该方案有望成为mCRC一线治疗方案。本研究在MSS mCRC患者中开展的3期部分目前正在进行中(NCT04547166),以进一步评估斯鲁利单抗联合贝伐珠单抗和XELOX作为MSS mCRC的一线治疗方案。
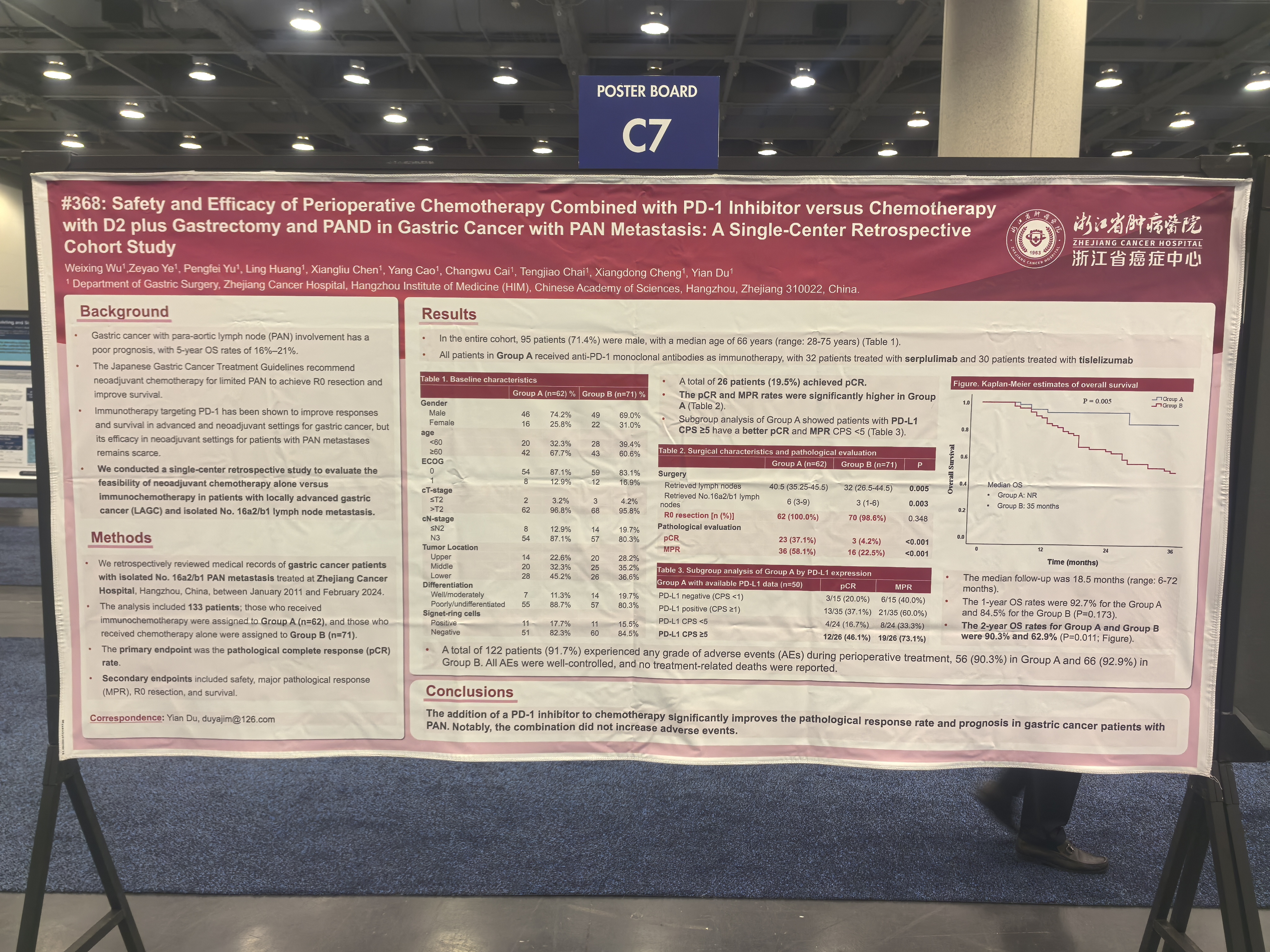
试验设计:本研究回顾性收集了133例浙江省肿瘤医院2011年1月至2024年2月的伴第16a2/b1腹主动脉旁淋巴结转移胃癌的患者信息,其中接受化疗联合免疫治疗的患者为队列A (n=62),仅接受化疗治疗的患者为队列B(n=71)。主要研究终点为病理完全缓解率 (pCR) ,次要研究终点为安全性、主要病理学缓解率 (MPR)、R0切除率和总生存期。
结果:所有入组的133例患者中,95例(71.4%) 患者为男性,中位年龄为66岁。接受化疗联合免疫治疗的队列A中,有32例患者使用斯鲁利单抗,30例患者使用替雷利珠单抗。队列A和队列B的主要研究终点pCR率分别为37.1% vs 4.2%(p<0.001),次要研究终点MPR率为58.1% vs. 22.5%(p<0.001),R0切除率为100% vs. 98.6%(p=0.348),2年OS率为90.3% vs. 62.9%(p=0.011)。亚组数据提示:PD-L1 CPS≥5的患者pCR和MPR获益最高。治疗期间,有122例 (91.7%)患者经历了任意级别的不良事件,所有不良事件均可控,无治疗相关死亡事件发生。
结论:相比于化疗,增加PD-1抑制剂可显著提升伴腹主动脉旁淋巴结转移胃癌的病理完全缓解率和预后,并未增加不良事件的发生。
HLX22

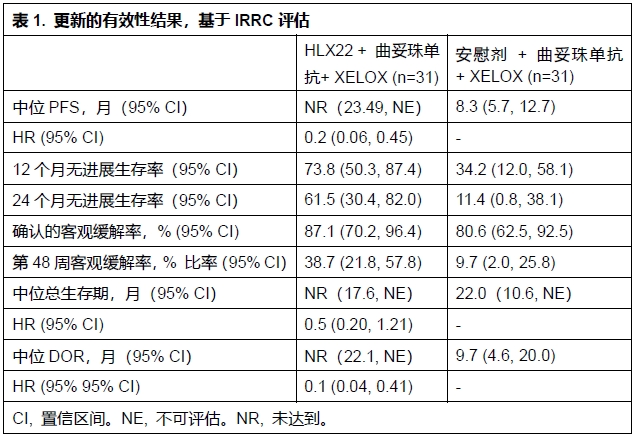
试验设计:本研究入组局部晚期或转移性HER2阳性G/GEJC且未接受过全身抗肿瘤治疗的患者。研究由两部分组成,本文报告第2阶段的结果。符合条件的患者按1:1比例随机分组,接受HLX22 15 mg/kg + 曲妥珠单抗 + XELOX或安慰剂 + 曲妥珠单抗+ XELOX治疗,每3周为一个周期。主要终点为独立影像评估委员会(IRRC)评估的无进展生存期(PFS)和根据实体瘤疗效评价标准(RECIST)v1.1的客观缓解率(ORR)。次要终点包括其他有效性终点和安全性终点。
结果:截至2024年6月30日,共有62例患者(31 vs 31)被随机分配到相应治疗组,其中51例患者(82.3%)为男性。中位随访时间分别为20.3m和24.0m。有效性结果见表1。治疗期不良事件(TEAEs)分别发生于30例(96.8%)和31例(100%)患者。与HLX22或安慰剂相关的≥3级TEAE分别发生于9例(29.0%)和6例(19.4%)患者。在安慰剂 + 曲妥珠单抗 + XELOX组中,有1例患者(3.2%)发生了HLX22/安慰剂相关的5级TEAE。
【参考文献】[1] Li N, et al. A randomized phase 2 study of HLX22 plus trastuzumab biosimilar HLX02 and XELOX as first-line therapy for HER2-positive advanced gastric cancer. Med. 2024;5(10):1255-1265.e2.[2] Jin Li, et al., HLX22 plus HLX02 and XELOX for first-line treatment of HER2-positive locally advanced or metastatic gastric/gastroesophageal junction cancer: A randomized, double-blind, multicenter phase 2 study. JCO 42, 354-354(2024).
