2022年6月6日,复宏汉霖(2696.HK)宣布,公司首个创新型单抗H药 汉斯状®(斯鲁利单抗)针对微卫星高度不稳定或错配修复缺陷(MSI-H/dMMR)实体瘤的关键性注册II期临床研究(ASTRUM-010)再次入选ASCO年会,数据更新将以海报形式展示。研究由中国人民解放军东部战区总医院秦淮医疗区秦叔逵教授和上海东方医院李进教授共同牵头开展。基于该试验结果,H药已正式获批用于治疗微卫星高度不稳定(MSI-H)实体瘤,以“泛癌种”治疗惠及广大实体瘤患者。
据统计,中国每年新发MSI-H肿瘤患者逾30万,MSI-H常见于子宫内膜癌、结直肠癌、胃癌等癌症,此类患者通常对于免疫检查点抑制剂有较高的应答率,PD-1/PD-L1作为重要的免疫抑制分子对于MSI-H特征型实体瘤患者具有较好的治疗效果。复宏汉霖就这一适应症开展的ASTRUM-010临床试验其结果曾分别于2021年ASCO年会、2021年CSCO年会上发布,此次ASCO年会上公布的该研究更新数据结果如下:
论文题目
创新型抗PD-1抗体斯鲁利单抗在经治疗、不可切除或转移性MSI-H/dMMR实体瘤患者中开展的Ⅱ期临床试验疗效及安全性结果更新(摘要编号:2592)
试验设计
此研究是一项在标准治疗失败的、不可切除或转移性MSI-H/dMMR实体瘤患者中进行的旨在评价斯鲁利单抗疗效、安全性及耐受性的单臂、开放标签、多中心、II期临床试验。纳入的患者每两周静脉输注3 mg/kg斯鲁利单抗,最多持续两年,或直到疾病进展、出现不可接受的毒性或患者退出。该试验的主要终点为独立影像评估委员会(IRRC)依据RECIST v1.1标准评估的客观缓解率(ORR)。次要终点包括由研究者评估的ORR,以及缓解持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)和安全性。
结果
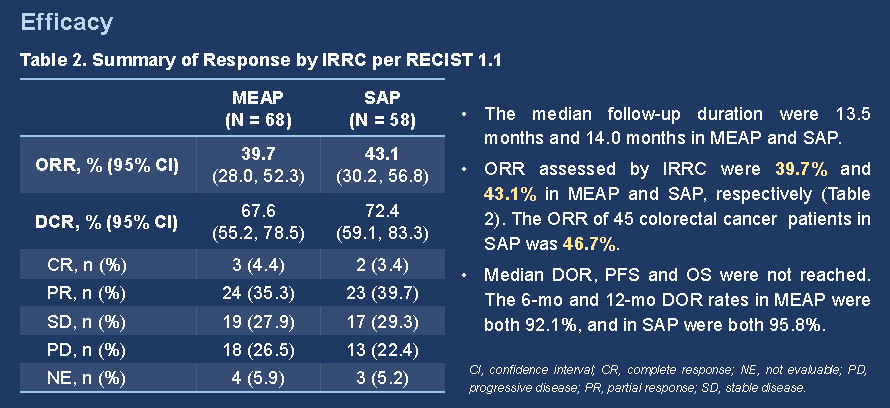
截至2021年7月10日,本试验共入组108名患者并纳入安全性分析集。其中68名经中心实验室或研究中心确认MSI-H的患者被纳入主要疗效分析人群,58名经中心实验室确认MSI-H,且无重大方案偏离的患者被纳入敏感性分析人群。主要疗效分析人群的中位随访时间为13.5个月,敏感性分析人群的中位随访时间为14.0个月。
主要疗效分析人群及敏感性分析人群中,经IRRC依据RECIST v1.1评估的ORR分别为39.7%(95% CI 28.0–52.3;3例完全缓解)和43.1%(95% CI 30.2–56.8;2例完全缓解)。中位DOR、PFS及OS尚未达到。主要疗效分析人群及敏感性分析人群的12个月生存率分别为74.5%和82.4%。
在安全性分析集中,57(52.8%)名患者经历了三级及以上的治疗期间出现的不良事件(TEAEs),其中最常见的为贫血(9.3%)。13(12.0%)名患者经历了三级及以上的免疫相关不良事件(irAEs)。试验中未观察到新的安全信号。
结论
综上所述,随着随访时间的增加,斯鲁利单抗仍展现出良好的抗肿瘤活性和安全性,为其作为一种有效的组织不确定类抗癌药物提供了有力的支持。
