2020年欧洲肿瘤学会亚洲分会(ESMO Asia年会)于11月20日至22日召开,此次ESMO Asia年会采取线上会议形式。会上,复宏汉霖自主开发的贝伐珠单抗HLX04(重组抗VEGF人源化单克隆抗体注射液)在中国结直肠癌患者中的3期临床研究HLX04-mCRC03数据以电子海报的形式发布,该研究的主要研究者为东部战区总医院秦淮医疗区秦叔逵教授和上海同济大学附属东方医院李进教授。
以下为本次数据发布的详细信息:
论文题目:一项比较HLX04或贝伐珠单抗参照药联合奥沙利铂或氟尿嘧啶类(XELOX或mFOLFOX6)一线治疗转移性结直肠癌的安全性、有效性的随机、双盲的3期临床试验
发布形式:电子海报
海报编号:104P
讲者:秦叔逵教授,东部战区总医院秦淮医疗区
展示时间:2020.11.19 12:00(北京时间)—2020.11.29 24:00(北京时间)
HLX04是复宏汉霖以原研贝伐珠单抗为参照药、按照国家《生物类似药研发与评价技术指导原则(试行)》自主开发的生物类似药。目前,该产品的上市注册申请(NDA)已正式获得国家药品监督管理局(NMPA)受理,有望用于晚期、转移性或复发性非小细胞肺癌以及转移性结直肠癌患者的治疗。区别于目前国内已上市的贝伐珠单抗生物类似药,HLX04在临床有效性、安全性3期比对研究的设计上选择了转移性结直肠癌为适应症,是目前国内唯一拥有转移性结直肠癌临床试验数据的贝伐珠单抗生物类似药,可为贝伐珠单抗在中国结直肠癌患者人群中的应用积累更多临床证据与经验。同时,这项3期临床研究数据也为HLX04与公司自有抗PD-1单抗HLX10组成免疫联合疗法提供了有力支持。值得一提的是,HLX10与HLX04的联合治疗方案为国内首个获得临床试验申请批准的国产单抗联合疗法,目前HLX04联合HLX10已在非鳞状非小细胞肺癌、肝细胞癌等多种实体瘤中开展多项临床研究,其中针对一线非鳞状非小细胞肺癌的临床试验已进入关键临床3期。
为发挥VEGF抑制剂在眼部疾病治疗中的潜力,惠及更多患者,复宏汉霖针对HLX04进行差异化开发,新增原研贝伐珠单抗尚未覆盖的湿性年龄相关性黄斑变性、糖尿病性视网膜病变两项眼科适应症,目前已获得国家药监局临床试验批准。同时,复宏汉霖携手合作伙伴亿胜生物共同开发HLX04治疗湿性年龄相关性黄斑变性(wAMD)等眼科适应症,充分发挥双方在产品研发和眼科药品全球商业化方面的优势。目前,复宏汉霖已就HLX04适用于眼科疾病而全新开发的安全、稳定的制剂配方提交了专利申请。
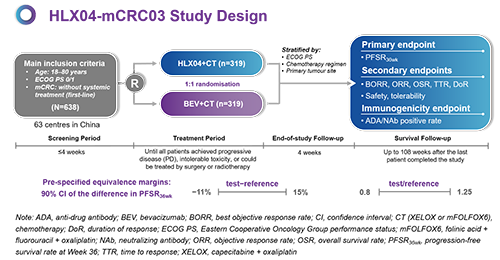
试验设计
HLX04-mCRC03是一项多中心、随机、双盲、平行对照的3期临床试验(临床试验号:NCT03511963),旨在比较HLX04或参照贝伐珠单抗联合化疗方案(XELOX方案或mFOLFOX6方案)一线治疗转移性结直肠癌的疗效、安全性和免疫原性。纳入的患者按照1:1的比例随机分为两组,分别静脉注射HLX04或原研贝伐珠单抗(联合XELOX时每三周注射一次,剂量为7.5 mg/kg,联合mFOLFOX6时每两周注射一次,剂量为5 mg/kg)。主要疗效终点为36周的无进展生存率(PFSR36wk)。
试验结果
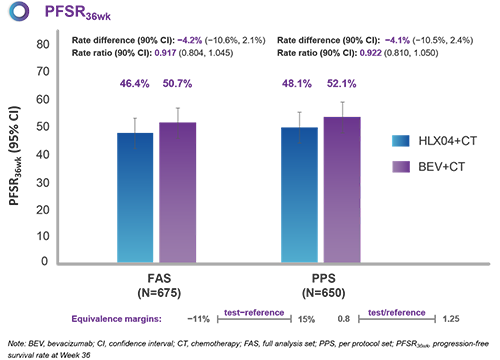
· 有效性-主要终点
本试验入组了675例病患(HLX04组,N=338;原研组,N=337)。在全分析集(FAS)中,HLX04组和原研组的PFSR36wk分别为46.4%和50.7%。两组率差为−4.2%(90%置信区间:−10.6%,2.1%),落于预先设定的等效界值(−11%,15%)范围之内,证明HLX04和原研贝伐珠单抗的疗效相似性。
· 有效性-次要终点
两治疗组的次要疗效终点如总生存期(OS)、无进展生存期(PFS)、客观缓解率(ORR)、至缓解时间(TTR)、缓解持续时间(DoR)等,均无统计学差异(p>0.05)。
· 安全性及免疫原性
HLX04和原研贝伐珠单抗的安全性和免疫原性特征相似。
结论
3期临床试验结果显示,HLX04与原研贝伐珠单抗在一线治疗转移性结直肠癌患者时,疗效、安全性和免疫原性特征相当。HLX04作为生物类似药候选药将为癌症患者带来更多治疗选择。