2025年12月29日,復宏漢霖(2696.HK)宣佈,公司自主研發的創新型重組人源化抗PD-L1與VEGF雙特異性抗體HLX37在晚期/轉移性實體瘤受試者中開展的首次人體臨床試驗(HLX37-FIH101)已於中國完成受試者給藥。
HLX37作用機制結合了兩種治療路徑:1)阻斷PD-1 /PD-L1結合:通過阻斷腫瘤細胞表面的PD-L1蛋白與免疫細胞(如T細胞)上的PD-1受體結合,解除腫瘤免疫抑制,恢復T 細胞對腫瘤的殺傷能力;2)阻斷血管生成通路:靶向VEGF,減少腫瘤血管生成,從而限制腫瘤的血液供應生長和轉移。研究表明,通過特異性結合腫瘤細胞PD-L1實現腫瘤內部具有抗VEGF功能的HLX37 雙抗分子的富集,HLX37能夠實現大於抗PD-L1 單抗和抗VEGF 單抗的聯合療效。臨床前研究表明,該候選分子具有優異的抗腫瘤活性且安全性可控,同時能增強腫瘤富集效應,在多類腫瘤中具有廣泛的應用潛力。該研究結果在2025年美國癌症研究協會(AACR)年會上首次發佈[1]。
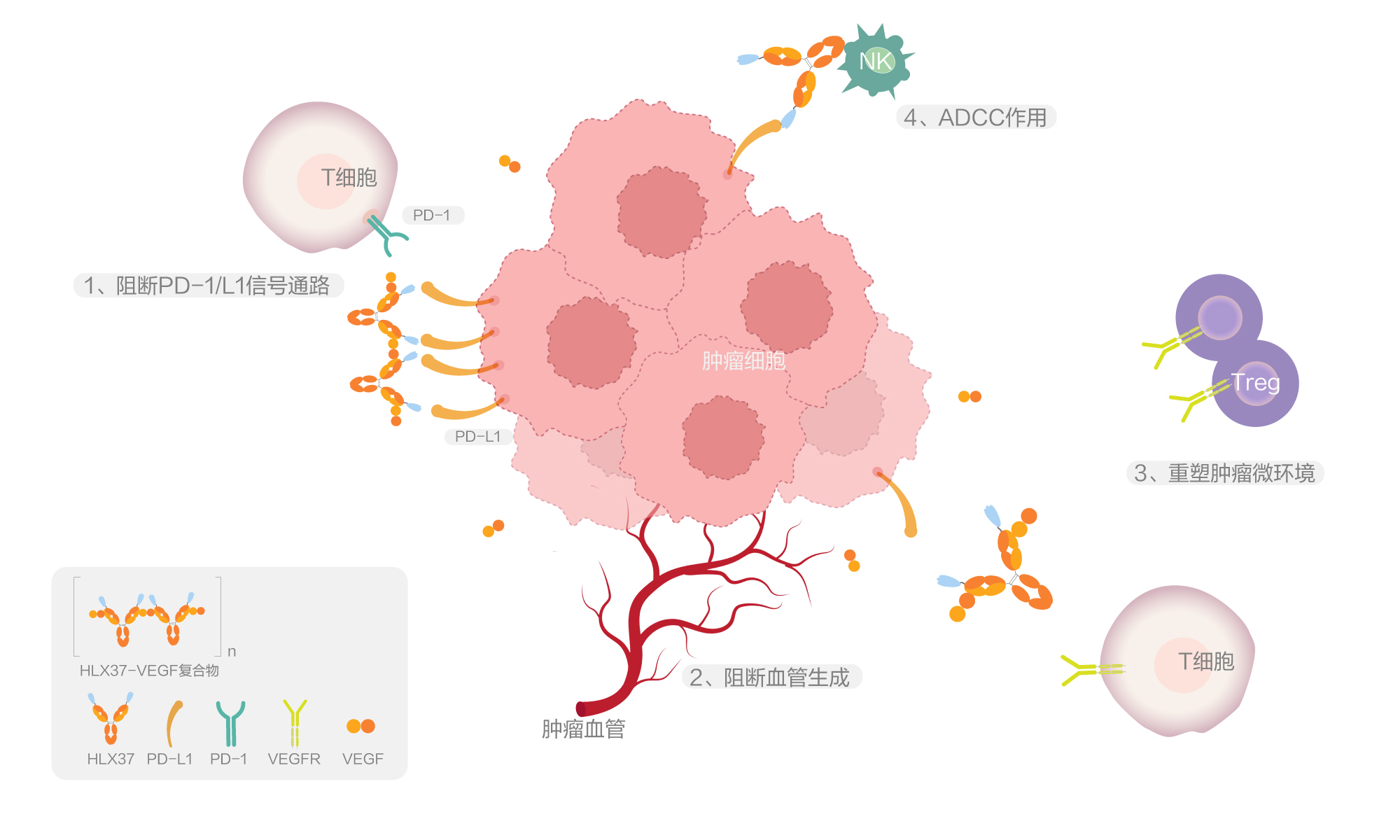
HLX37由抗VEGF 抗體與抗PD-L1的VHH片段融合而成, 該VHH序列篩選自復宏漢霖的合成VHH庫。復宏漢霖已構建起「從源頭發現到規模化生產」的一體化抗體技術平台,成為驅動差異化抗體藥物研發的核心引擎。平台聚焦功能阻斷性抗體開發,打造了強大的天然/合成人源化/免疫羊駝VHH多樣化抗體庫,可針對不同靶點靈活篩選出高親和力、高特異性的納米抗體(VHH)及scFv,為多特異性抗體等創新分子的開發奠定基礎。同時,基於長期行業積澱,公司已系統性建立多特異性抗體(雙抗/三抗/四抗)與抗體融合蛋白的發現、構型設計與功能表徵數據庫,顯著提升了複雜抗體分子的開發效率與成功率。依託於該平台,公司已累計實現了10款產品的獲批上市,並持續推進19款臨床階段資產(涵蓋創新單抗/ADC/融合蛋白/生物類似藥)的高效開發,在研臨床項目超過30項,通過全鏈條的開發能力與獲驗證的規模化CMC體系,加速推動潛力候選分子轉化為高質量的臨床與商業化產品。
未來,復宏漢霖將繼續秉持「以患者為中心」的初心和理念,深耕實體瘤這一重要疾病領域,通過不斷挖掘患者未滿足的臨床需求,持續夯實更多創新分子的差異化佈局,為更多腫瘤患者帶來高質量、可負擔的新型治療方案。
【參考文獻】
[1] Song G, Chen Y-S, et al. Abstract 7303: A novel anti-PD-L1/VEGF bispecific antibody (HLX37) with immune checkpoint inhibition, anti-angiogenic, and antineoplastic activities. Cancer Res 15 April 2025; 85 (8_Supplement_1): 7303. AACR Annual Meeting 2025.
關於HLX37-FIH101
HLX37-FIH101是一項評估HLX37在晚期/轉移性實體瘤受試者中安全性、耐受性、藥代動力學(PK)特徵及初步療效的開放性、首次人體I期臨床試驗,共分為Ia期劑量遞增(含單藥及聯合治療)和Ib期劑量擴展兩個階段。Ia期單藥治療針對晚期實體瘤受試者,設置1.0 mg/kg至45.0 mg/kg共6個劑量水平,每三周給藥一次;聯合治療將在晚期非小細胞肺癌受試者中探索不同劑量HLX37聯合培美曲塞或白蛋白紫杉醇/紫杉醇及卡鉑的方案;Ib期的給藥方案及擬擴展瘤種將根據Ia期研究結果決定。本研究的主要終點旨在評估劑量限制性毒性(DLT)發生率,以確定單藥及聯合治療的最大耐受劑量(MTD)和II期推薦劑量(RP2D);次要終點包括不良事件等安全性指標、PK參數、免疫原性,以及客觀緩解率(ORR)、無進展生存期(PFS)和總生存期(OS)等療效指標,同時探索潛在預測性生物標誌物。
