2025年8月6日,復宏漢霖(2696.HK)宣佈,潛在同類首創(first-in-class)人唾液酸酶融合蛋白HLX79(E-602)聯合漢利康®(利妥昔單抗)治療活動期腎小球腎炎的II期臨床試驗(HLX01HLX79-GN201)於中國完成首例患者給藥。漢利康®現已在中國獲批用於治療非霍奇金淋巴瘤(NHL)、慢性淋巴細胞白血病(CLL)、類風濕性關節炎(RA),是目前國內唯一獲批用於自身免疫疾病治療的利妥昔單抗。此外,漢利康®亦在拉美多國獲批用於治療血管炎肉芽腫(GPA)、顯微鏡下多血管炎(MPA)和尋常型天疱瘡(PV)等自身免疫疾病。
終末期腎病(ESRD)是慢性腎臟病(CKD)的終末階段,這一階段患者腎功能幾乎完全喪失,需長期依靠腎臟替代治療維持生命,具有疾病嚴重程度高、多併發症高發、治療花費負擔重等特點[1]。中國ESRD患者數量位居全球首位,佔比接近30%,折合現有患者人數達350萬[2]。而中國終末期腎病的主要病因為腎小球腎炎,包括原發性腎小球腎炎和繼發性腎小球腎炎。原發性腎小球腎炎包括膜性腎病(MN)、局灶節段性腎小球硬化(FSGS)等。繼發性腎小球腎炎包括狼瘡腎炎(LN)、抗中性粒細胞胞質抗體(ANCA)相關性血管炎(AAV)腎損害等[1]。
近年來,以利妥昔單抗(抗CD20單抗)等靶向抗體為代表的B細胞清除療法,已在全球多個市場獲批並被中華醫學會腎臟病學專家共識推薦用於治療腎小球腎炎[1]。然而,許多患者對這類藥物的治療反應並不理想。糖免疫提供了一種治療自身免疫疾病的新方法。該策略通過酶解唾液酸糖苷,打破致病性免疫細胞的「保護屏障」, 從而增強其清除效果,幫助恢復機體免疫平衡。
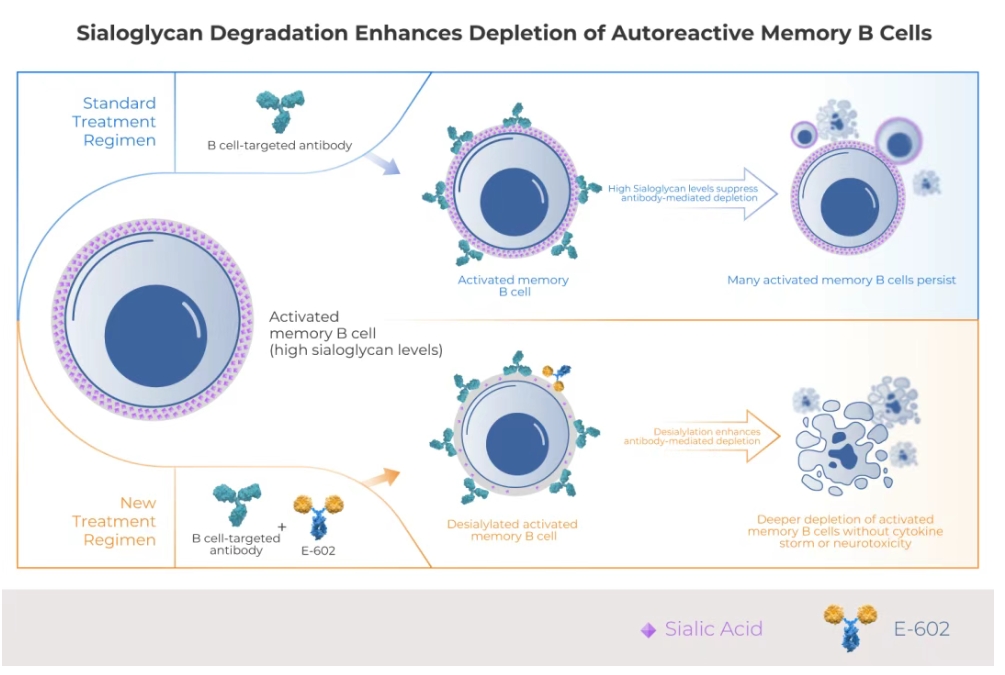
HLX79是基於Palleon的EAGLE糖編輯平台開發的潛在「同類首創」的人唾液酸酶融合蛋白。HLX79 通過酶解唾液酸糖苷,從而增強對兩類在自身免疫疾病中高度致病的免疫細胞的清除:一是驅動炎症的自身反應性記憶B細胞,二是促進纖維化和器官損傷的M2型巨噬細胞。
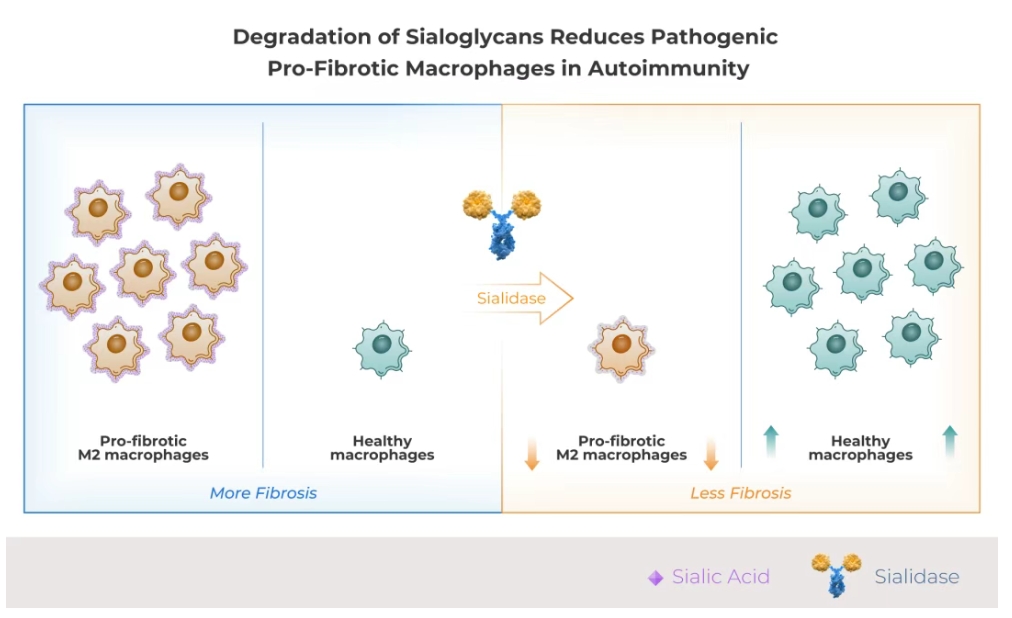
臨床前研究表明,與利妥昔單抗單藥相比,HLX79與利妥昔單抗聯用的療效顯著提升,且不會引發CAR-T療法或T細胞結合劑相關的細胞因子釋放綜合症(CRS)或免疫效應細胞相關神經毒性綜合症(ICANS)。在此前的臨床試驗中,HLX79展現出良好的安全性特徵,無劑量限制性毒性。HLX79聯用利妥昔單抗有望為活動期腎小球腎炎患者帶來臨床獲益。
未來,復宏漢霖還將持續立足於未滿足的臨床需求,充分發揮公司在抗體藥物領域的一體化平台優勢,不斷拓展疾病領域和新分子類型,為全球患者帶來更多高質量、可負擔的創新治療方案。
參考文獻
[1] 中華醫學會腎臟病學分會專家組. 利妥昔單抗在腎小球腎炎中應用的專家共識[J]. 中華腎臟病雜誌, 2022, 38(2):151-160.
[2] IQVIA《中國終末期腎病白皮書》
關於HLX01HLX79-GN201
本研究為一項雙盲、隨機對照、多中心的2期臨床試驗,旨在評估HLX79聯合漢利康®對比安慰劑在活動期腎小球腎炎(狼瘡腎炎(LN)和膜性腎病(MN))患者中的有效性、安全性和耐受性。研究分為兩個階段,第一階段為劑量遞增期,按照劑量遞增設計原則,合格的受試者將每周一次接受HLX79(10 mg/kg、20 mg/kg或30 mg/kg)聯合漢利康®或漢利康®安慰劑(375 mg/m2)給藥,主要研究目的為評價HLX79聯合漢利康®對比安慰劑聯合漢利康®治療活動期腎小球腎炎的安全性和耐受性;第二階段為初步療效探索期,篩選合格的受試者將按照2:2:1:1的比例,每周一次接受HLX79(高劑量/低劑量)聯合漢利康®(375 mg/m2)、HLX79安慰劑聯合漢利康®、或HLX79安慰劑聯合漢利康®安慰劑給藥,主要研究目的為在標準治療基礎上,評價HLX79聯合漢利康®、安慰劑聯合漢利康®以及安慰劑治療活動期腎小球腎炎的臨床療效,次要研究目的為評估其他臨床療效、安全性、耐受性、藥代動力學(PK)特徵和免疫原性,探索性目的為評估潛在生物標誌物的動態變化。
