2025年5月16日,復宏漢霖(2696.HK)宣佈,公司自主研製的伊匹木單抗生物類似藥HLX13(重組抗CTLA-4全人單克隆抗體注射液)的I/III期臨床研究(NCT06841185)在中國完成首例受試者給藥。復宏漢霖已於2025年4月與Sandoz達成授權許可合作,授予Sandoz對HLX13在美國、歐洲42個國家和地區、日本、加拿大及澳大利亞的獨家商業化權益。
近年來,免疫療法為腫瘤治療提供了新的途徑,具有獨特的優勢和巨大的潛力。腫瘤免疫檢查點抑制劑是腫瘤免疫治療中的重要組成部分[1]。與PD-1/L1、LAG-3相似,細胞毒性T淋巴細胞相關抗原4(cytotoxic T-lymphocyte-associated protein 4, CTLA-4)也是一類免疫抑制型檢查點蛋白,主要表達在調節性T細胞和活化的T細胞上。與CD28相比,CTLA-4對B7分子的親和力更強,通過與CD28競爭性結合抗原呈遞細胞上的B7配體(B7-1和B7-2),抑制T細胞的增殖和活化[2]。全人抗CTLA-4單克隆抗體能夠解除CTLA-4對T細胞活化所需的共刺激信號的抑制,增加活性效應T細胞的數量,從而動員 T 細胞對腫瘤細胞發動直接免疫攻擊。此外,抗CTLA-4單抗可選擇性地耗盡腫瘤部位的調節T細胞,導致腫瘤內效應T細胞/調節T細胞的比例增加,從而導致腫瘤細胞死亡。研究證明,伊匹木單抗注射液與PD-1抑制劑組成的雙免疫聯合療法能夠產生協同的抗腫瘤效果,為患者帶來更大的臨床獲益[3-4]。截至目前,伊匹木單抗聯合納武利尤單抗已在全球多個國家和地區獲批,適應症包括聯合納武利尤單抗用於黑色素瘤、肝細胞癌等一系列適應症。
HLX13(抗CTLA-4單抗)藥理作用示意圖
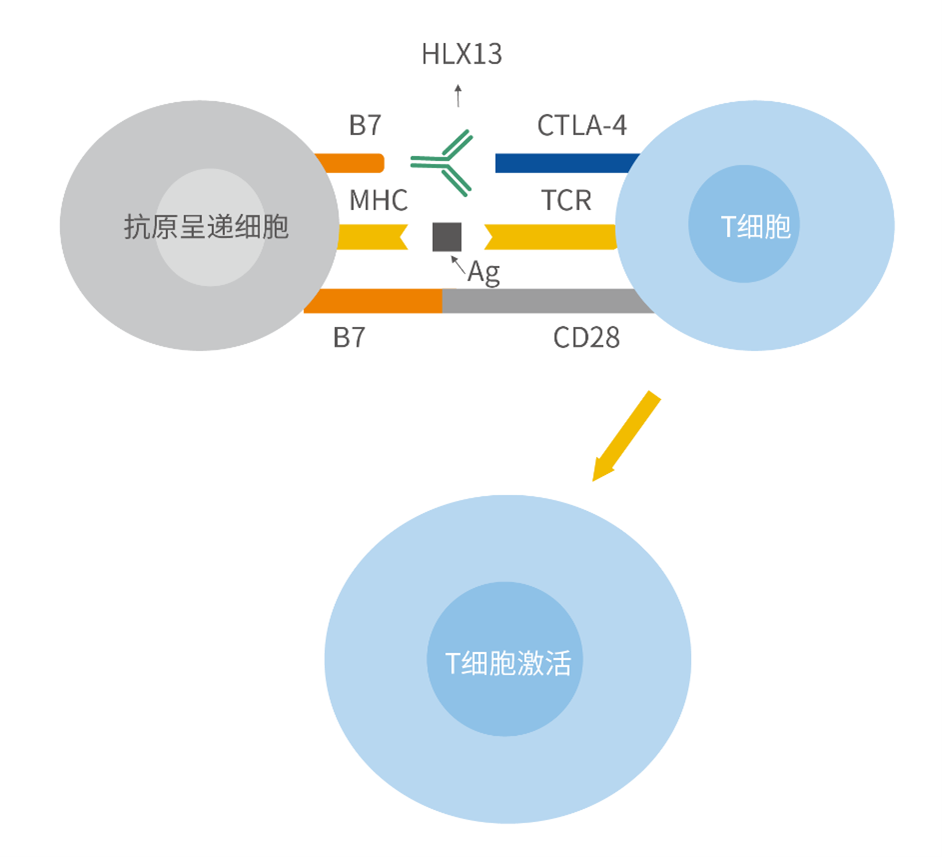
HLX13是復宏漢霖嚴格按照中國、歐盟和美國等生物類似藥法規自主研發的伊匹木單抗注射液生物類似藥,有望用於多種實體瘤的治療。公司已經完成了HLX13與原研藥伊匹木單抗注射液的藥學、臨床前藥理學、毒理學和藥代動力學全面對比研究,上述臨床前研究未發現HLX13與原研藥伊匹木單抗注射液存在顯著差異。
未來,復宏漢霖還將持續立足於未滿足的臨床需求,充分發揮公司在抗體藥物和抗體偶聯藥物領域的一體化平台優勢,持續探索免疫治療在腫瘤中的治療潛力,為全球患者帶來更多高質量、可負擔的創新治療方案。
關於NCT06841185
本研究為一項多中心、隨機、雙盲、平行對照1/3期臨床研究,旨在評估HLX13與其原研藥YERVOY®(美國市售和歐盟市售)在既往未經治療的不可切除的晚期肝細胞癌(HCC)患者中的藥代動力學(PK)特徵、有效性、安全性和免疫原性相似性。合格的受試者將按2:1:1的比例隨機分配至三組,在前4個周期,受試者每3周接受一次HLX13、美國市售的YERVOY®或歐盟市售的YERVOY®治療,三組均聯合納武利尤單抗。隨後每4周接受一次納武利尤單抗治療,最多10個周期。主要PK終點為從給藥前至首次給藥後21天的血藥濃度-時間曲線下面積(AUC0-21d)和穩態給藥間隔內血藥濃度-時間曲線下面積(AUCss);主要有效性終點為由獨立放射學審查委員會(IRRC)根據實體腫瘤臨床療效評價標準(RECIST v1.1)評估的直至第24周的最佳客觀緩解率(ORR)。次要終點包括其他PK參數、其他有效性評估、安全性及免疫原性。
