近日,復宏漢霖地舒單抗生物類似藥候選藥物HLX14(重組抗RANKL 全人單克隆抗體注射液)的I期臨床研究(NCT04534582)數據發表於Clinical and Translational Science(IF 3.1)。研究結果顯示,HLX14與美國、歐盟和中國市售的原研地舒單抗的藥物代謝動力學特徵和藥效學具有高度相似性,安全性、耐受性和免疫原性均可比,該研究達到了所有預設的主要研究終點。

HLX14為復宏漢霖按照中國、歐盟和美國等生物類似藥相關法規自主開發的地舒單抗生物類似藥。復宏漢霖已於2022年與Organon達成授權許可和供應合作,授予其對包括HLX14在內的兩款候選生物類似藥在除中國以外的全球區域進行獨家商業化的權益,協議覆蓋美國、歐盟、加拿大等市場。2024年4月,HLX14用於治療骨折高風險的絕經後婦女的骨質疏鬆症的國際多中心臨床III期對照研究(NCT05352516)達到主要研究終點。基於一系列的頭對頭比對研究,HLX14的上市申請於2024年相繼獲得美國食品藥品監督管理局(FDA)、歐洲藥品管理局(EMA)和加拿大衛生部(Health Canda)受理。
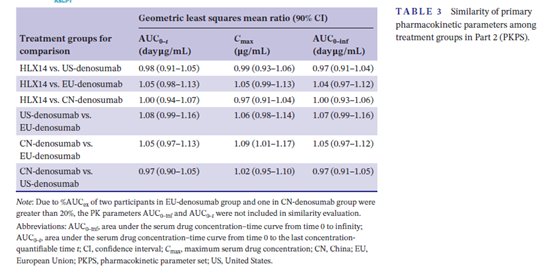
NCT04534582研究是一項在中國健康成年男性受試者中開展的兩階段I期臨床試驗。第一階段為開放標籤、隨機、平行對照、單次給藥、雙臂研究。主要研究目的為比較HLX14和歐盟市售的原研地舒單抗(PROLIA)在皮下給藥後的藥物代謝動力學參數,以進一步為第二部分臨床研究方案設計提供依據。次要研究目的為比較HLX14與歐盟市售的原研地舒單抗(PROLIA)的藥效學、安全性、耐受性和免疫原性。第二階段是一項雙盲、隨機、平行對照、單次給藥、四臂研究,主要目的為比較HLX14與美國、歐盟及中國市售的原研地舒單抗(參照藥)的藥物代謝動力學特徵的相似性,次要目的為比較HLX14與參照藥的藥效學、安全性、耐受性和免疫原性。主要研究終點為AUC0–t、Cmax和AUC0–inf。
研究數據顯示,HLX14與美國、歐盟及中國市售的原研地舒單抗在藥物代謝動力學特徵和藥效學具有高度相似性。第二階段中,對於所有3個主要研究終點,HLX14和參照藥的幾何平均均值比(GMRs)均接近1,且其90%置信區間(CIs)均落在預設的等效性界值區間(0.8~1.25)範圍內(AUC0–t,0.91-1.13;Cmax,0.91-1.13;AUC0–inf,0.91-1.12)。
安全性與耐受性方面,HLX14相比參照藥或市售其它地舒單抗生物類似藥,未發現新的安全性信號。所有受試者均發生了治療相關不良事件(TEAEs),其中大多數為1–2級。
HLX14有望為全球患者提供一種新的治療選擇,進一步豐富復宏漢霖在全球市場的產品佈局。未來,復宏漢霖將持續以臨床需求為導向,為全球患者提供更多可負擔、療效更好的治療方案。
