
以下為此次發佈的詳細信息:
試驗設計: 本研究為一項隨機、雙盲、國際、平行對照的III期研究。受試者為年齡在60至90歲之間、確認已絕經且腰椎或全髖骨礦物質密度(BMD)T評分通過中心雙能X線吸收法掃描為−4.0 < T評分 ≤ −2.5的女性。合格的受試者按1:1分配分別接受兩劑HLX14或歐盟市售原研地舒單抗(PROLIA)。在第52周,接受PROLIA的受試者再次按1:1隨機分配接受第三劑HLX14或PROLIA。本研究的共同主要終點為第52周腰椎BMD(LS-BMD)從基線變化的百分比(由中心影像評估)及基線至第26周的血清膠原蛋白C端肽(s-CTX)較基線改變百分比-時間曲線下面積 (AUEC0-26W)。次要終點包括腰椎BMD基線變化百分比(由研究者評估),股骨頸及全髖部BMD的百分比變化(由中心影像及研究者評估),骨折率,s-CTX及血清N-末端I型前膠原肽(s-P1NP)的相對變化百分比,安全性,藥代動力學(PK),和免疫原性。
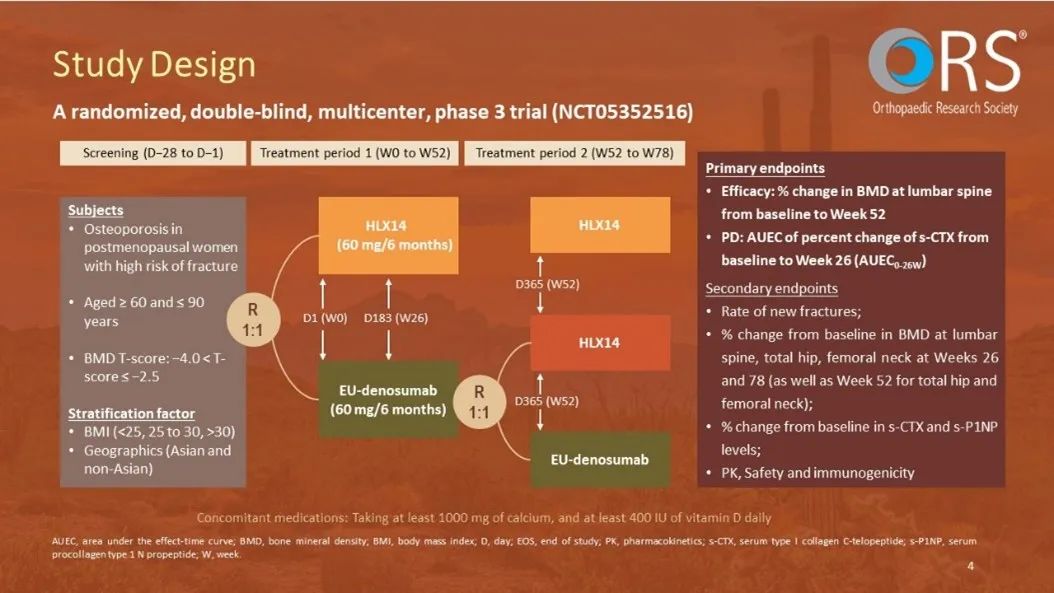
結果: 在2022年6月17日至2024年6月5日期間,共有514例受試者被隨機分配到HLX14組(256名)或歐盟市售原研地舒單抗(PROLIA)組(258名)。在第52周,來自PROLIA組的220例受試者再次隨機分配,接收最後一劑HLX14(PROLIA/HLX14組,110名)或PROLIA(PROLIA/PROLIA組,110名);HLX14組的220例受試者繼續接受最後一劑HLX14(HLX14/HLX14組)。
在基線到第52周期間,HLX14組和PROLIA組的腰椎骨密度(LS-BMD)均有所增加。通過中央影像評估,從基線到第52周的平均(標準偏差)百分比變化分別為HLX14組6.10%(3.95%),PROLIA組5.90%(3.83%)。兩組之間的調整平均差異為0.23%(90%置信區間[CI]:−0.36%,0.83%;95% CI:−0.48%,0.95%)。90%置信區間和95%置信區間均落在預設的等效性界限−1.45%到1.45%之間, 證明了兩組療效等效性。對於主要藥效動力學(PD)終點,HLX14組和PROLIA組的AUEC0-26W幾何均值(CVb%)分別為14075.1253(17.3%)day*%inhibition,13883.3613(17.9%)day*%inhibition。HLX14組和PROLIA組AUEC0-26W的幾何均值比為1.01(90% CI:0.99, 1.04;95% CI:0.98, 1.05)。幾何均值比的90%和95%置信區間均落在預設的等效性界限0.8到1.25之間,證明兩組PD等效性。因此,本研究的共同主要終點已達到。所有敏感性、補充性和亞組分析結果也與主要分析一致。所有次要療效終點的結果進一步支持了HLX14和歐盟市售原研地舒單抗(PROLIA)等效。

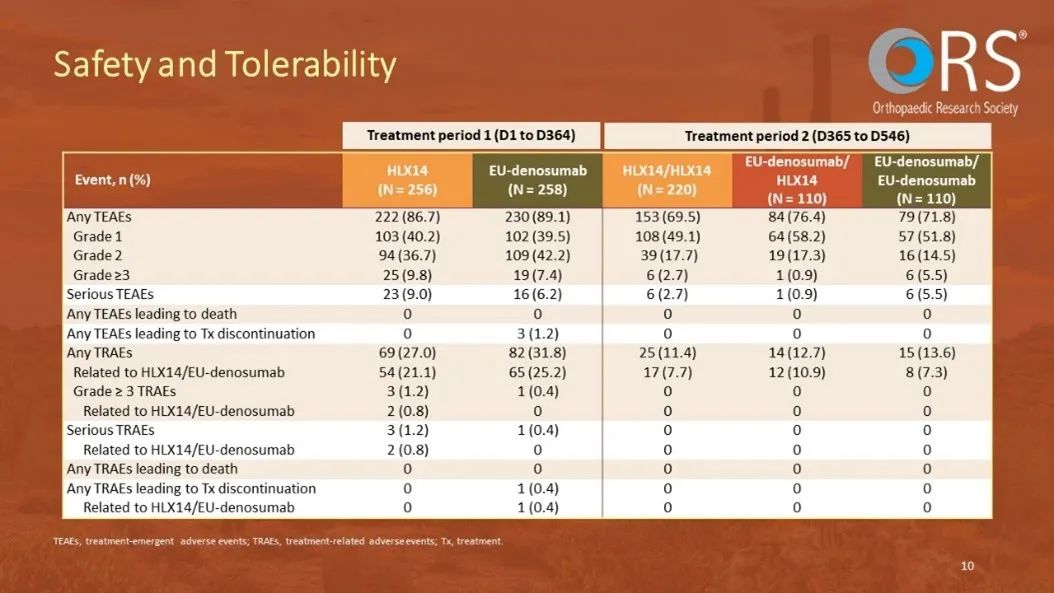
在基線到第52周期間,兩組的安全性結果相當;HLX14組出現了69例(27.0%)與治療相關的不良事件(TRAEs),而PROLIA組出現了82例(31.8%)。從第52周到第78周,PROLIA/HLX14、PROLIA/PROLIA、HLX14/HLX14各組之間的安全性特徵仍相似;PROLIA/HLX14組報告了14例(12.7%)TRAEs,PROLIA/ PROLIA組報告了15例(13.6%),HLX14/HLX14組報告了25例(11.4%)。總體而言,安全性評估未發現HLX14和PROLIA之間存在顯著差異,即使在單次治療藥物轉換之後也是如此。各組在單次藥物轉換前後的抗藥抗體和中和抗體的發生率也相當。
結論: 綜上所述,HLX14與歐盟市售原研地舒單抗在療效上具有等效性,並且二者的安全性特徵相似。本研究的結果支持 HLX14 作為地舒單抗的生物類似藥,在獲批上市後,將可以提高骨折風險的絕經後女性對抗骨質疏鬆症和骨質流失的有效治療方法的可及性。
