2023年2月1日,復宏漢霖(2696.HK)宣佈,公司自主開發的達雷妥尤單抗生物類似藥HLX15(重組抗CD38全人單克隆抗體注射液)的I期臨床研究(NCT05679258)於中國完成首例受試者給藥。
HLX15是復宏漢霖自主開發的一款全人源抗CD38 IgG1κ單克隆抗體,有望用於治療多發性骨髓瘤(Multiple myeloma,MM)。多發性骨髓瘤是一種克隆漿細胞異常增殖的惡性疾病,多發於老年,在很多國家是血液系統第2位常見的惡性腫瘤[1]。根據2020年世界衛生組織(World Health Organization,WHO)披露的流行病學數據顯示,全球5年現患率45萬餘,2020年新發病例約17.6萬,死亡11.7萬餘;中國5年現患5.1萬餘,2020年新發病例2.1萬餘,死亡1.6萬餘[2-4]。
CD38又名環狀二磷酸腺苷(Adenosine diphosphate,ADP)核糖水解酶,通常表達於漿細胞、淋巴樣和髓樣細胞。它是一種多功能酶,能夠降解煙酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD),以及調節細胞內NAD的穩態,在多種生物學過程中發揮着非常重要的作用,包括正常生理水平下的代謝調節以及參與病理條件下的疾病發生等,疾病類型包括衰老、肥胖、糖尿病、心臟病等[5]。同時研究發現,CD38在大量惡性血液癌症特別是多發性骨髓瘤等癌症中高度表達,是血液瘤的細胞表面標誌物,被認為是多發性骨髓瘤治療性抗體藥物的理想開發靶點[6-7]。
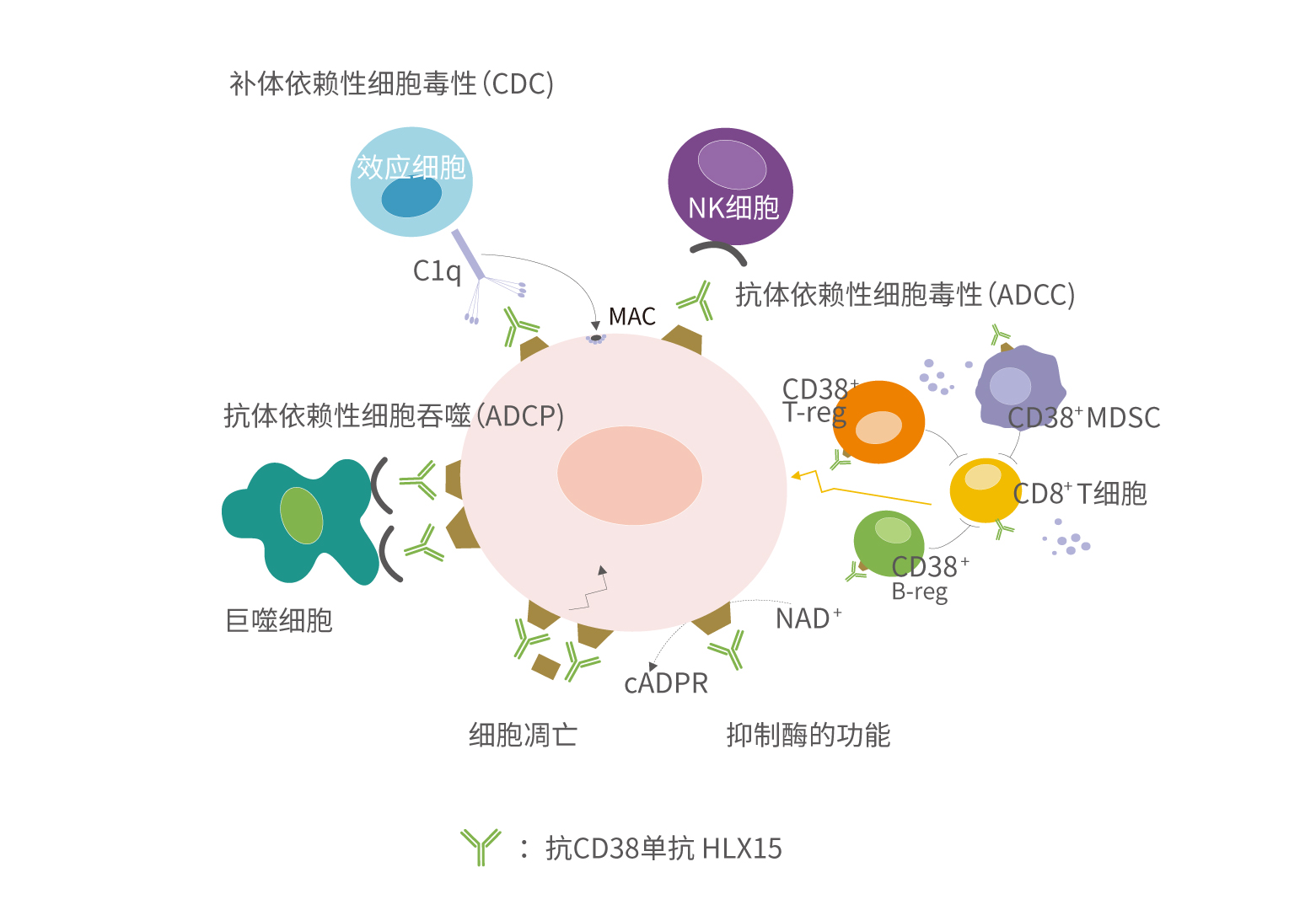
HLX15一方面可直接與腫瘤細胞表面表達的CD38結合,通過補體依賴的細胞毒作用(Complement dependent cytotoxicity,CDC)、抗體依賴的細胞毒作用(Antibody dependent cellular cytotoxicity,ADCC)、抗體依賴的細胞吞噬作用(Antibody dependent cellular phagocytosis,ADCP)、以及Fc介導的交聯作用等多重反應誘導骨髓瘤細胞凋亡和溶解,達到快速緩解;此外,HLX15還可通過降低髓源性抑制細胞和消耗CD38表達陽性的免疫調節性T、B細胞來調節免疫微環境,增強免疫系統對腫瘤細胞的抑制作用。
參照NMPA發佈的《生物類似藥研發與評價技術指導原則(試行)》和EMA發佈的Guideline on Similar Biological Medicinal Products的要求,復宏漢霖採用逐步遞進、比對及相似性評價原則,對HLX15與原研達雷妥尤單抗進行了頭對頭的藥學分析和體內外藥理學比對研究。臨床前研究結果顯示,HLX15和原研達雷妥尤單抗在具有高度相似性。
復宏漢霖從臨床需求出發,目前已打造出多元化的創新產品管線,在PD-1/L1、LAG-3、TIGIT、BRAF等極具市場潛力的靶點全面佈局。同時,公司將持續加碼創新,加強優質創新資產的引進和合作,「內外兼修」,不斷擴充創新潛力靶點,為全球患者帶去更多質高價優的生物藥,以造福全球病患。
關於NCT05679258
本研究為一項在中國男性健康受試者中比較HLX15和達雷妥尤單抗注射液的藥代動力學特徵、安全性、耐受性和免疫原性的1期臨床研究。此研究分為兩個部分。第一部分為單中心、隨機、開放、雙臂1a期研究,將納入24例受試者,按1:1的比例隨機分配接受靜脈輸注單劑量(8 mg/kg)的HLX15或中國市售達雷妥尤單抗(兆珂®)。此外在第一部分的早期階段將設置安全導入期,額外納入3–6例受試者接受靜脈輸注HLX15,並進行為期1周的安全性觀察。第二部分為多中心、隨機、雙盲、三臂1b期研究,將納入204例受試者,按1:1:1的比例隨機分配接受靜脈輸注單劑量(8 mg/kg)的HLX15、美國市售達雷妥尤單抗(DARZALEX®)或中國市售達雷妥尤單抗(兆珂®)。本研究的主要終點為從0至無窮大時間血藥濃度-時間曲線下面積(AUC0-inf)。次要終點包含其他藥代動力學參數、安全性、和免疫原性。
【參考文獻】
[1] 中國醫師協會血液科醫師分會, 中華醫學會血液學分會. 中國多發性骨髓瘤診治指南(2022年修訂) [J] . 中華內科雜誌, 2022, 61(5) : 480-487. DOI: 10.3760/cma.j.cn112138-20220309-00165.
[2] Wang, S., et al., Prevalence and Incidence of Multiple Myeloma in Urban Area in China: A National Population-Based Analysis. Frontiers in Oncology, 2020. 9.
[3] WHO-Multiple myeloma - Global Cancer Observatory-2020.
[4] Cowan AJ, Green DJ, Kwok M, et al. Diagnosis and Management of Multiple Myeloma: A Review. JAMA. 2022;327(5):464-477.
[5] Chini, E.N., et al., The Pharmacology of CD38/NADase: An Emerging Target in Cancer and Diseases of Aging. Trends Pharmacol Sci, 2018. 39(4): p. 424-436.
[6] Bonello, F., M. D'Agostino, M. Moscvin, C. Cerrato, M. Boccadoro, and F. Gay. 2018. 'CD38 as an immunotherapeutic target in multiple myeloma', Expert Opin Biol Ther, 18: 1209-21.
[7] Morandi, F., A. L. Horenstein, F. Costa, N. Giuliani, V. Pistoia, and F. Malavasi. 2018. 'CD38: A Target for Immunotherapeutic Approaches in Multiple Myeloma', Front Immunol, 9: 2722.
