2022年11月5日至11月12日,第25屆全國臨床腫瘤學大會暨2022年CSCO學術年會以線上與線下結合的方式召開。11月6日,復宏漢霖創新抗PD-1單抗H藥 漢斯狀®(斯魯利單抗)在微衛星高度不穩定(MSI-H)實體瘤的關鍵性II期臨床研究數據更新由浙江省腫瘤醫院鍾海均教授以口頭報告形式在免疫治療綜合專場發佈。
此前,H藥在食管鱗狀細胞癌(ESCC)中開展的關鍵性III期臨床研究數據已於全體大會首次發佈並獲選優秀論文,由中國醫學科學院腫瘤醫院黃鏡教授進行了口頭報告,同步也將於11月12日在食管癌專場由中國醫學科學院腫瘤醫院宋岩教授進行報告。
以下為H藥在MSI-H實體瘤II期臨床研究的數據更新詳情:
論文題目:Efficacy and safety of serplulimab, a novel anti-PD-1 antibody, in patients with previously treated unresectable or metastatic microsatellite instability-high or mismatch repair-deficient solid tumors: updated results from ASTRUM-010 study
聯合主要研究者:秦叔逵,中國人民解放軍東部戰區總醫院秦淮醫療區;李進,同濟大學附屬東方醫院
展示形式:口頭報告
主講人:鍾海均,浙江省腫瘤醫院
匯報地點:濟南會場,免疫治療綜合專場
匯報時間:11月6日 16:10-16:16
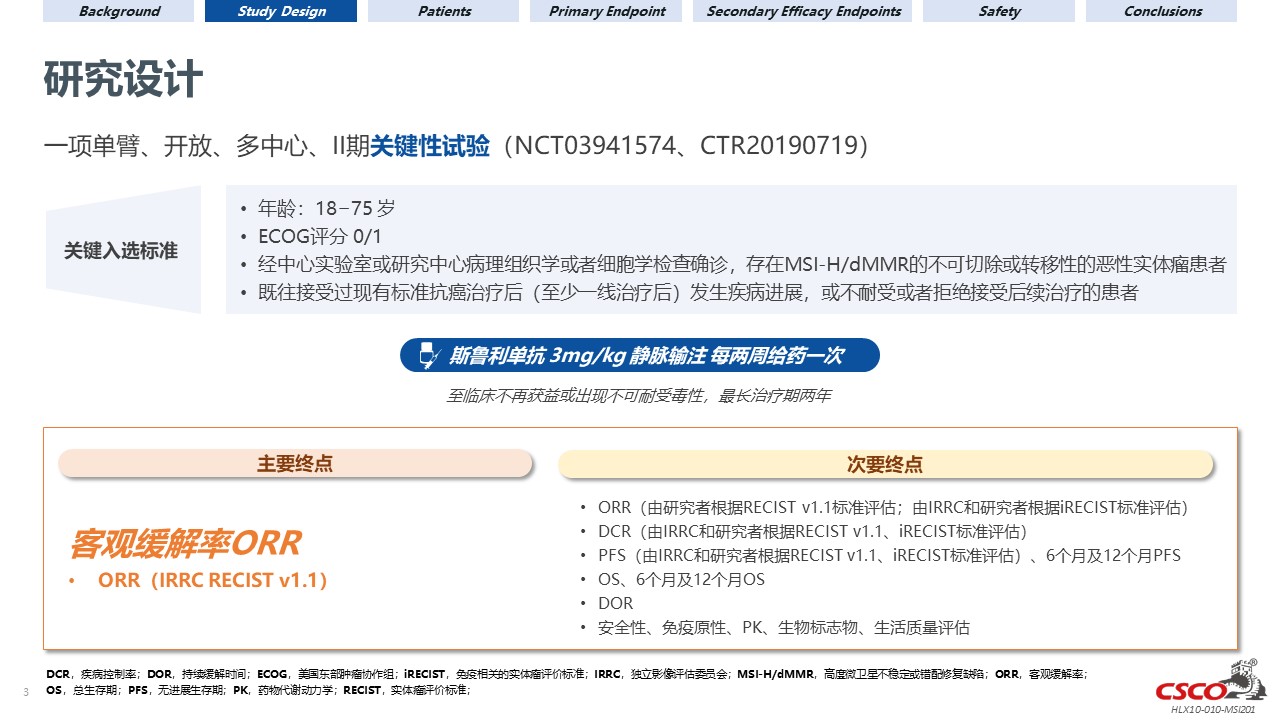
試驗設計
此研究是一項在標準治療失敗的、不可切除或轉移性高度微衛星不穩定(MSI-H)或錯配修復缺陷型實體瘤患者中進行的旨在評價斯魯利單抗療效、安全性及耐受性的單臂、開放標籤、多中心、II期臨床試驗。納入的患者每兩周靜脈輸注3 mg/kg斯魯利單抗,最多持續兩年,或直到疾病進展、出現不可接受的毒性或患者退出。該試驗的主要終點為獨立影像評估委員會(IRRC)依據RECIST v1.1標準評估的客觀緩解率(ORR)。次要終點包括由研究者評估的ORR,以及緩解持續時間(DOR)、無進展生存期(PFS)、總生存期(OS)和安全性。
試驗結果
截至2021年7月10日,本試驗共入組108名患者並納入安全性分析集。其中68名經中心實驗室或研究中心確認MSI-H的患者被納入主要療效分析人群,58名經中心實驗室確認MSI-H,且無重大方案偏離的患者被納入敏感性分析人群。主要療效分析人群的中位隨訪時間為13.5個月,敏感性分析人群的中位隨訪時間為14.0個月。主要療效分析人群及敏感性分析人群中,經IRRC依據RECIST v1.1評估的ORR分別為39.7%(95% CI 28.0–52.3;3例完全緩解)和43.1%(95% CI 30.2–56.8;2例完全緩解)。
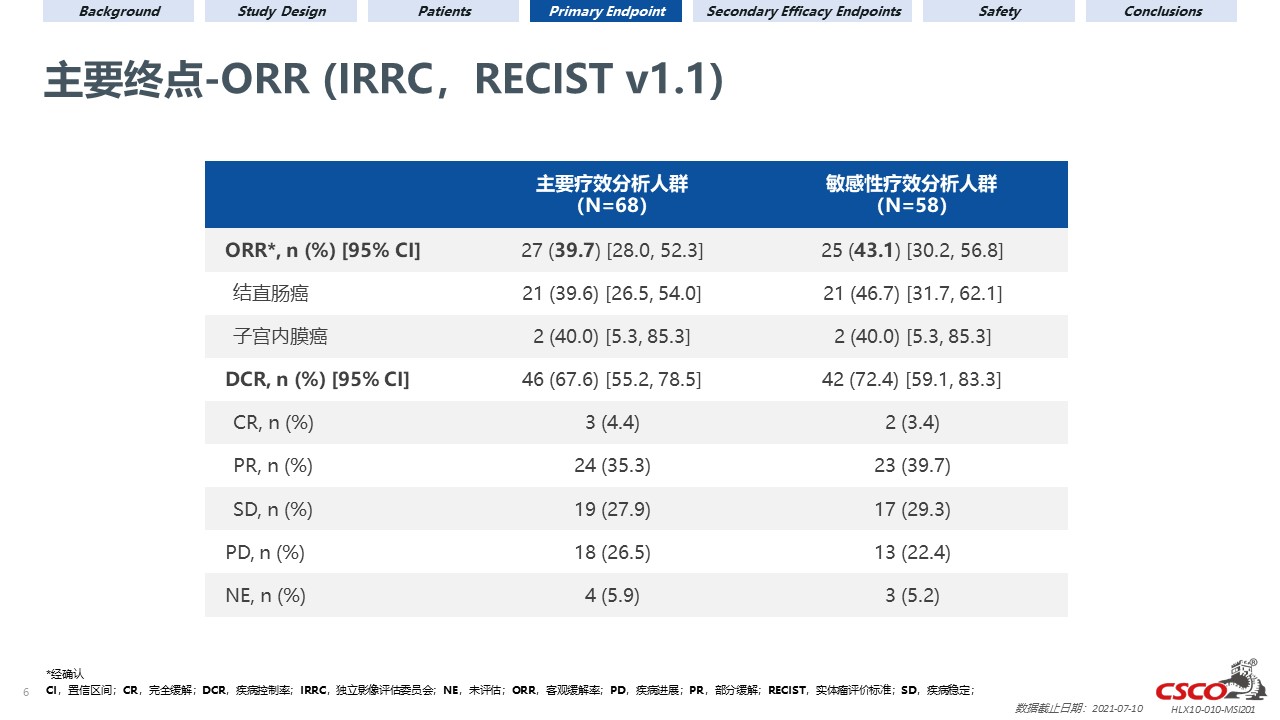
主要療效分析人群及敏感性分析人群中,研究者評估的ORR分別為38.2%(95% CI 26.7–50.8;1例完全緩解)和41.4%(95% CI 28.6–55.1;1例完全緩解)。中位DOR、PFS及OS尚未達到。主要療效分析人群及敏感性分析人群的12個月生存率分別為74.5%(95% CI 62.2–83.3)和82.4%(95% CI 69.7–90.1)。
在安全性分析集中,57(52.8%)名患者經歷了三級及以上的治療期間出現的不良事件(TEAEs),其中最常見的為貧血(9.3%)。13(12.0%)名患者經歷了三級及以上的免疫相關不良事件(irAEs)。3(2.8%)名患者發生了可能與斯魯利單抗相關的死亡(2例疾病進展,1例腸梗阻)。
結論
隨着隨訪時間的增加,斯魯利單抗仍展現出良好的抗腫瘤活性和安全性,為其作為一種有效的泛癌種抗癌藥物提供了有力的支持。
