2024年6月4日,复宏汉霖(2696.HK)宣布,公司首个创新型单抗H药 汉斯状®(斯鲁利单抗)多项结果入选2024 ASCO年会。其中由吉林省肿瘤医院程颖教授担任主要研究者的H药一线治疗广泛期小细胞肺癌(ES-SCLC)III期临床研究(ASTRUM-005),以及由中山大学肿瘤防治中心/华南肿瘤学国家重点实验室/广东省恶性肿瘤临床医学研究中心徐瑞华教授担任主要研究者的H药联合汉贝泰®(HLX04,贝伐珠单抗)和化疗用于一线治疗转移性结直肠癌(mCRC)的II/III期临床研究(ASTRUM-015)数据更新在年会上以壁报形式展示。
H药是全球首个获批一线治疗小细胞肺癌的抗PD-1单抗,截至目前在中国已获批用于治疗微卫星高度不稳定(MSI-H)实体瘤、鳞状非小细胞肺癌(sqNSCLC)、ES-SCLC及食管鳞状细胞癌(ESCC)。H药联合化疗一线治疗非鳞状非小细胞肺癌(nsNSCLC)和一线治疗ES-SCLC的上市申请也分别获得中国NMPA和欧盟EMA受理。以H药为基础,公司在全球开展多元化的肿瘤免疫联合疗法,并充分运用自有管线覆盖肿瘤特异性靶点、抗血管生成靶点和肿瘤免疫靶点等,助力H药与单抗、化疗等治疗手段开展联合治疗。以临床需求为导向,公司就H药在消化道肿瘤和肺癌领域进行了差异化、多维度布局,适应症广泛覆盖肺癌、食管鳞癌、头颈鳞癌和胃癌等高发大癌种,在全球范围内累计入组逾3900名受试者。
肺癌是全球最常见的恶性肿瘤之一。其中小细胞肺癌(SCLC)约占肺癌总数的15%[1],是肺癌中侵袭性最强的亚型,分为局限期小细胞肺癌(LS-SCLC)和ES-SCLC。基于关键性临床研究ASTRUM-005,H药已在中国和印度尼西亚获批ES-SCLC适应症。该研究结果于2022年ASCO年会上首次报告,并登顶《美国医学会杂志》(JAMA),随后,其数据更新于2022年欧洲肿瘤学会亚洲分会(ESMO Asia)年会上发布。
结直肠癌(CRC)是全球最常见的恶性肿瘤之一。根据最新版中国癌症统计报告数据显示,中国的CRC发病率、死亡率在全部恶性肿瘤中分别位居第2和第4位,其中2022年新发病例51.7万,死亡病例24万[2]。复宏汉霖基于mCRC标准一线治疗方案,通过ASTRUM-015研究进一步开展免疫疗法探索,希望为更多结直肠癌患者提供更有效的治疗方法。该研究临床试验结果首次发布于2024年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)。
此次ASCO年会上H药多项研究数据结果如下:
ASTRUM-005研究
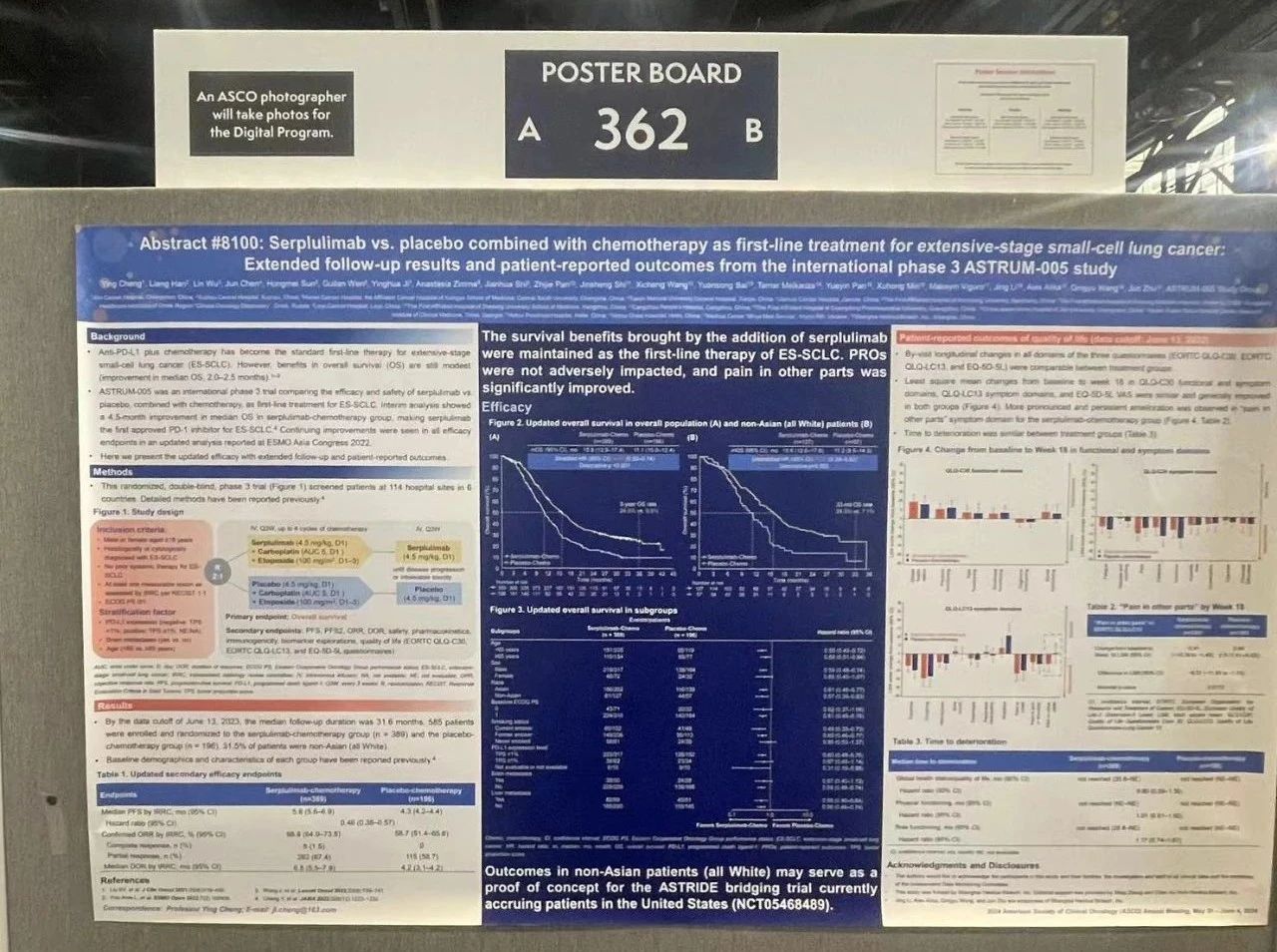
论文题目
斯鲁利单抗与安慰剂联合化疗一线治疗广泛期小细胞肺癌:国际III期研究ASTRUM-005的延长随访结果及患者报告数据
试验设计
ASTRUM-005是一项随机、双盲、III期试验,旨在比较斯鲁利单抗(新型抗PD-1抗体)联合化疗与安慰剂联合化疗一线治疗广泛期小细胞肺癌(ES-SCLC)的疗效和安全性。585例既往未接受过系统性治疗的ES-SCLC患者按2:1的比例随机分组(斯鲁利单抗组,n = 389;安慰剂组,n = 196),每三周一次接受静脉输注斯鲁利单抗4.5 mg/kg或安慰剂。所有患者均接受最多四个周期的卡铂和依托泊苷治疗,每三周一次静脉给药。分层因素包括PD-L1表达水平、脑转移和年龄。主要终点是总生存期(OS)。患者报告数据(PROs)采用EORTC QLQ-C30、EORTC QLQ-LC13和EQ-5D-5L问卷进行评估。
结果
至2023年6月13日数据截止时,斯鲁利单抗组267(68.6%)例患者和安慰剂组160(81.6%)例患者已死亡。随访时间为31.6个月。斯鲁利单抗组的中位OS明显长于安慰剂组(15.8 vs. 11.1个月;分层HR 0.61,95% CI 0.50–0.74)。按人种进行的亚组分析显示,亚洲人(未分层HR 0.61,95% CI 0.48–0.77)和非亚洲人(均为白人;未分层HR 0.57,95% CI 0.39–0.83)的中位OS均有类似的延长趋势。两组患者估计的3年OS率分别为24.6%(95% CI 19.5–30.1)和9.8%(95% CI 5.6–15.4)。两组患者在三份问卷的所有评估量表中的按随访纵向变化情况相当。两组患者的QLQ-C30功能及症状量表、QLQ-LC13症状量表和EQ-5D-5L视觉模拟量表从基线到第18周的最小二乘均值(LSM)变化相似且普遍有所改善,其中斯鲁利单抗组的“其他部位疼痛”症状量表改善更明显、更持久(LSM变化差异为−6.37 [95% CI −11.59至−1.15],p = 0.0170)。两组患者的至恶化时间相当:整体健康状况/生活质量(HR 0.90,95% CI 0.59–1.39)、躯体功能(HR 1.01,95% CI 0.61–1.65)和角色功能(HR 1.17,95% CI 0.74–1.87);至恶化时间的中位数均未达到。
结论
随着随访时间的延长,联合斯鲁利单抗一线治疗ES-SCLC给患者带来了持续的生存获益。斯鲁利单抗组患者PROs与安慰剂组相比类似或稍好,如其中“其他部位疼痛”改善在斯鲁利单抗组更为明显。以上这些结果均支持斯鲁利单抗联合化疗作为一种有前景的ES-SCLC一线治疗方案。
ASTRUM-015研究
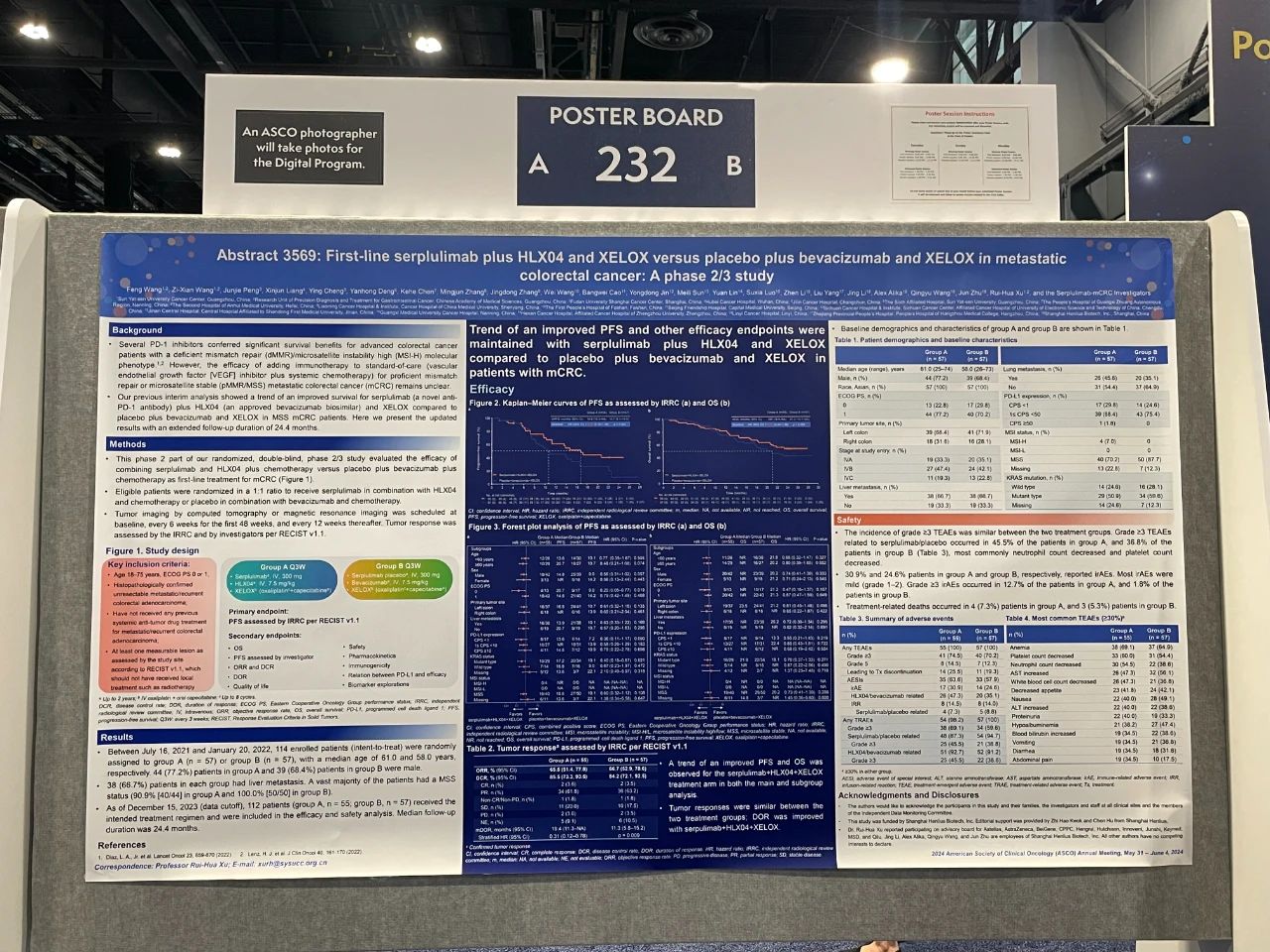
论文题目
斯鲁利单抗联合HLX04和XELOX对比安慰剂联合贝伐珠单抗和XELOX一线治疗转移性结直肠癌:一项II/III期研究
试验设计
这是一项随机、双盲、多中心的II/III期研究,旨在比较斯鲁利单抗(新型抗PD-1抗体)联合HLX04(已获批的贝伐珠单抗生物类似药)和XELOX化疗与安慰剂联合贝伐珠单抗和XELOX,一线治疗转移性结直肠癌(mCRC)的疗效和安全性。在II期试验部分,114例既往未接受过系统性治疗的mCRC患者按1:1的比例随机分组(斯鲁利单抗组,n = 57;安慰剂组,n = 57),分别接受静脉输注斯鲁利单抗(300 mg)联合HLX04(7.5 mg/kg)和XELOX(奥沙利铂130 mg/m2静脉给药加卡培他滨1000 mg/m2口服)(A组)或安慰剂联合贝伐珠单抗和XELOX(B组)治疗,每三周一次。分层因素为PD-L1表达水平、ECOG PS评分和原发肿瘤部位。主要终点是独立影像评估委员会(IRRC)根据RECIST 1.1评估的无进展生存期(PFS)。次要终点包括其他疗效终点、安全性、药代动力学、生物标志物探索和生活质量评估。
结果
截止2023年12月15日(数据截止日期),随访时间为24.4个月;斯鲁利单抗联合HLX04和XELOX化疗组一线治疗mCRC的主要终点中位无进展生存期(PFS)对比安慰剂联合化疗组有着明显的改善趋势;中位PFS为16.8个月 vs. 10.7个月(HR = 0.58)。并且亚组分析表明,在微卫星稳定(MSS)(16.8个月 vs. 10.1个月,HR = 0.60)、KRAS 突变(17.2个月 vs. 10.1个月,HR = 0.40)和肝转移患者中(13.9个月 vs. 10.1个月,HR = 0.63)等亚组中持续观察到潜在的 PFS 改善趋势。次要终点中位总生存期(OS)分析结果显示了斯鲁利单抗联合HLX04和XELOX化疗组的OS改善趋势;中位OS为尚未达到vs. 21.2个月(HR = 0.74),并也在各亚组中一致观察到了潜在的OS改善趋势。斯鲁利组的中位持续缓解时间(DOR)也均显著优于安慰剂联合化疗组;19.4个月 vs. 11.3个月(HR = 0.31)。
结论
随着随访时间的延长,联合斯鲁利单抗一线治疗mCRC给患者带来了持续的生存获益,且安全性可控。这些结果支持斯鲁利单抗联合HLX04和XELOX作为一种非常有前景的mCRC一线治疗方案,值得进一步研究。
ASTRUM-005R研究

论文题目
ASTRUM-005R:斯鲁利单抗联合化疗一线治疗广泛期小细胞肺癌的真实世界多中心研究
结论
斯鲁利单抗联合化疗一线治疗ES-SCLC的真实世界生存结局,为临床实践提供有价值的见解,验证ASTRUM-005研究结果,为斯鲁利单抗联合依托泊苷和铂类一线治疗ES-SCLC补充有力证据。
一项针对局限期小细胞肺癌的回顾性研究

论文题目
免疫检查点抑制剂联合化疗新辅助治疗局限期小细胞肺癌:一项回顾性研究
结论
新辅助免疫检查点抑制剂联合化疗治疗LS-SCLC显示出良好的疗效和可行性,可作为LS-SCLC潜在治疗选择,期待开展前瞻性临床试验,进一步证明免疫联合化疗新辅助LS-SCLC的获益所在,优化LS-SCLC治疗策略。
一项针对非小细胞肺癌的随机对照、开放、II期临床研究

论文题目
斯鲁利单抗联合含铂双药化疗诱导治疗局部晚期非小细胞肺癌:一项随机对照、开放、II期临床试验
结论
斯鲁利单抗联合化疗诱导治疗可使一半不可切除的IIIB-IIIC期NSCLC成功降期,转化为可手术切除,具有良好的疗效和安全性。
一项针对食管胃结合部肿瘤的临床研究

论文题目
斯鲁利单抗联合同步放化疗新辅助治疗局晚可切除食管胃结合部肿瘤的II期临床研究初步结果
结论
本研究数据初步证明了斯鲁利单抗联合同步放化疗新辅助治疗局晚可切除食管胃结合部肿瘤患者的有效性和安全性。
一项针对胃癌患者姑息性治疗的单中心回顾性研究

论文题目
以斯鲁利单抗为基础的治疗方案在胃癌患者姑息性治疗中的疗效和安全性分析:一项单中心回顾性研究
结论
回顾性研究数据表明:以斯鲁利单抗为基础的联合治疗可以达到控制肿瘤生长的目的,在晚期胃癌患者中具有良好的有效性和安全性。
一项针对神经内分泌癌的研究

论文题目
索凡替尼联合EP加斯鲁利单抗一线治疗神经内分泌癌的疗效和安全性
结论
索凡替尼联合EP方案和斯鲁利单抗一线治疗NEC初步显示出显著的疗效和安全性。
一项针对食管癌的真实世界研究

论文题目
斯鲁利单抗一线治疗局部进展或者转移性食管癌(EC)患者中的有效性及安全性评估:一项真实世界研究
结论
本回顾性研究数据显示:斯鲁利单抗联合化疗治疗食管癌方案显示出卓越的疗效和安全性。
【参考文献】
[1] Eskandar A, Ahmed A, Daughtey M, et al. Racial and sex differences in presentation and outcomes of small cell lung cancer in the United States: 1973 to 2010[J].Chest, 2015,147(4): e164-e165.
[2] B Han et al. J Natl Cancer Cent, 4(1), 47-53 (2024).
关于H药
H药 汉斯状®为重组人源化抗PD-1单抗注射液(通用名:斯鲁利单抗注射液),是全球首个获批一线治疗小细胞肺癌的抗PD-1单抗,已在中国和印度尼西亚获批上市。截至目前,H药已有4项适应症获批上市,2项适应症上市申请分别在中国和欧盟获受理,10余项临床试验同步在全球开展。
2022年3月,H药正式于中国获批上市,目前可用于治疗微卫星高度不稳定(MSI-H)实体瘤、鳞状非小细胞肺癌(sqNSCLC)、广泛期小细胞肺癌(ES-SCLC)及食管鳞状细胞癌(ESCC)。H药联合化疗一线治疗非鳞状非小细胞肺癌(nsNSCLC)和一线治疗广泛期小细胞肺癌(ES-SCLC)的上市申请也分别获得中国NMPA和欧盟EMA受理。聚焦肺癌和消化道肿瘤,复宏汉霖积极推进H药与公司其他产品的协同以及与创新疗法的联合,在全球同步开展10余项肿瘤免疫联合疗法临床试验,于中国、美国、土耳其、波兰、格鲁吉亚等国家和地区累计入组超3900人。H药的4项关键性临床研究结果分别发表于知名期刊《美国医学会杂志》(JAMA)、《自然-医学》(Nature Medicine)、Cancer Cell和British Journal of Cancer。此外,H药还荣获《CSCO 小细胞肺癌诊疗指南》、《CSCO非小细胞肺癌诊疗指南》、《CSCO 食管癌诊疗指南》、《CSCO结直肠癌诊疗指南》、《CSCO免疫检查点抑制剂临床应用指南》和《中国食管癌放射治疗指南》等多部权威指南推荐,为肿瘤临床诊疗提供重要参考。海外方面,H药治疗SCLC也已获得美国FDA和欧盟EC的孤儿药资格认定,并在美国启动了一项H药对比一线标准治疗阿替利珠单抗的头对头桥接试验。
