近日,复宏汉霖自主开发的创新型产品H药 汉斯状®(斯鲁利单抗,抗PD-1单抗)、抗EGFR单抗HLX07、抗LAG-3单抗HLX26在晚期实体瘤患者中开展的多项I/II期临床研究成果入选2023 ESMO Asia年会,以壁报的形式进行现场展示,包括由复旦大学附属中山医院樊嘉教授牵头开展的HLX10-008-HCC201,广东省人民医院吴一龙教授牵头开展的HLX10HLX07-sqNSCLC-201,南方医科大学南方医院李常兴教授牵头开展的HLX07-CSCC201,及徐州市中心医院武焱旻教授牵头开展的HLX26-002。其中,HLX07-CSCC201研究结果获评本届大会“最佳壁报”奖。
H药 汉斯状®(斯鲁利单抗)
H药 汉斯状®为复宏汉霖自主开发的重组人源化抗PD-1单抗注射液(通用名:斯鲁利单抗注射液),是全球首个获批一线治疗小细胞肺癌的抗PD-1单抗。自2022年3月获批上市以来,H药目前可用于治疗微卫星高度不稳定(MSI-H)实体瘤、鳞状非小细胞肺癌(sqNSCLC),广泛期小细胞肺癌(ES-SCLC)及食管鳞状细胞癌(ESCC)四项适应症。此外,H药联合化疗一线治疗广泛期小细胞肺癌(ES-SCLC)的上市申请也已经获得欧盟EMA受理,有望于2024年上半年获批。聚焦肺癌和消化道肿瘤,复宏汉霖积极推进H药与公司其他产品的协同以及与创新疗法的联合,相继获得中国、美国、欧盟等国家及地区的临床试验许可,在全球同步开展10余项肿瘤免疫联合疗法临床试验。
HLX10-008-HCC201
论文题目
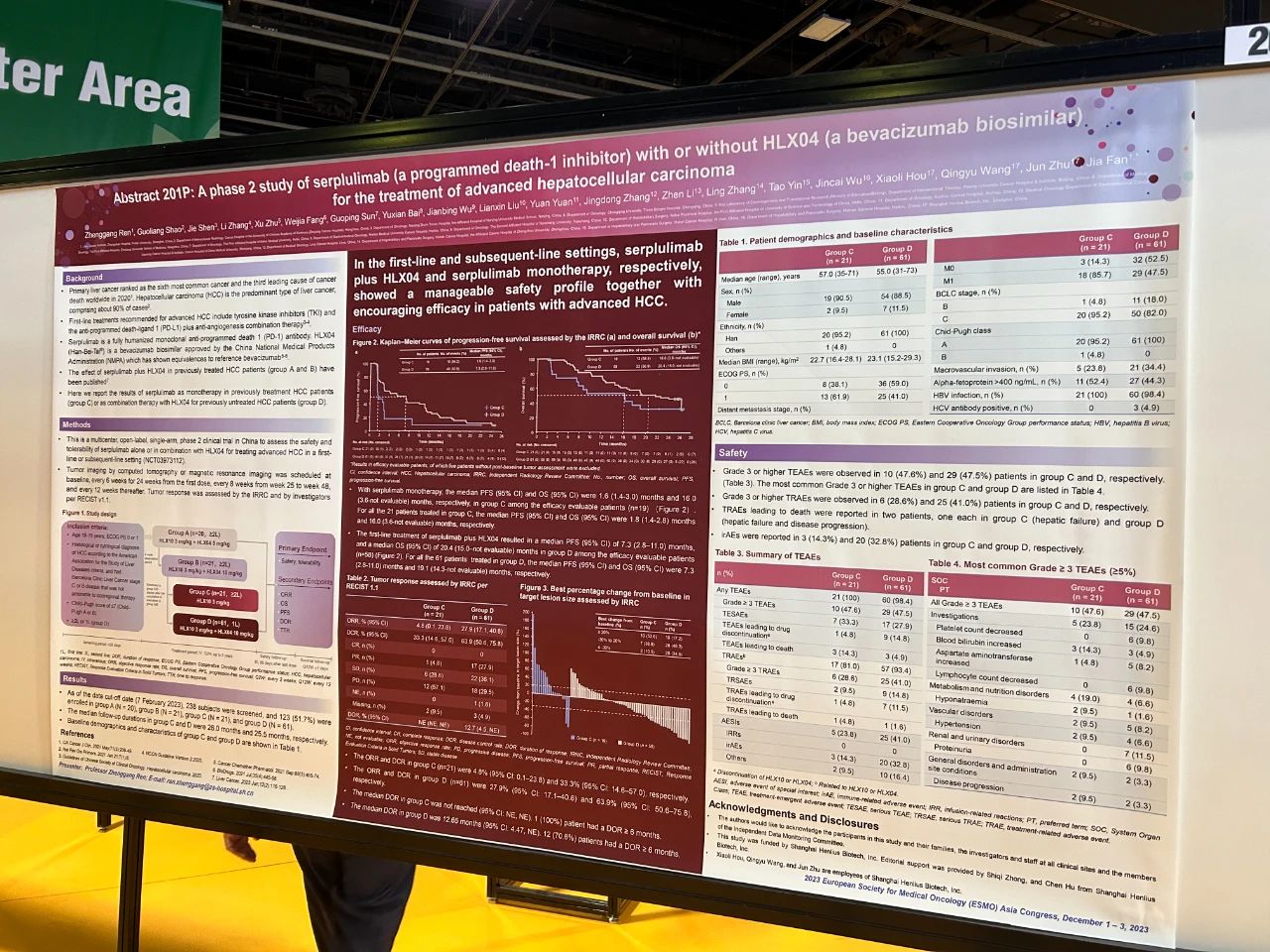
一项斯鲁利单抗(程序性死亡-1抑制剂)联合或不联合HLX04(贝伐珠单抗生物类似药)治疗晚期肝细胞癌II期研究
试验设计
既往系统性治疗失败的晚期肝细胞癌患者接受斯鲁利单抗3 mg/kg联合HLX04 5 mg/kg(A组)、斯鲁利单抗3 mg/kg联合HLX04 10 mg/kg(B组)或斯鲁利单抗3 mg/kg单药治疗(C组)。既往未接受过系统性治疗的晚期HCC患者被纳入D组,接受斯鲁利单抗3 mg/kg联合HLX04 10 mg/kg的治疗。所有治疗均采用静脉输注,每两周一次。主要终点是安全性。
结果
这项开放标签、多中心II期研究在中国进行;共28家医院有患者入组。A组和B组的结果先前已发表;这里我们展示了C组和D组的结果。截至2023年2月7日,C组和D组分别有21例和61例患者入组。中位随访时间分别为26.0个月和25.5个月。C组和D组分别有10(47.6%)例和29(47.5%)例患者报告了≥3级的治疗期间出现的不良事件。C组有1(4.8%)例患者死于治疗相关的肝衰竭;D组有1(1.6%)例患者死于治疗相关的肝衰竭和疾病进展。C组经独立影像评估委员会(IRRC)根据RECIST v1.1评估的客观缓解率为4.8%(95%置信区间[CI] 0.1–23.8),D组为27.9%(95% CI 17.1–40.8)。C组和D组经IRRC评估的中位无进展生存期分别为1.8个月(95% CI 1.4–2.8)和7.3个月(95% CI 2.8–11.0)。C组和D组的中位总生存期分别为16.0个月(95% CI 3.6–无法评估[NE])和19.1个月(95% CI 14.3–NE)。
结论
斯鲁利单抗联合HLX04和斯鲁利单抗单药分别在晚期HCC患者的一线和后线治疗中展现出可控的安全性和良好的疗效。
创新型抗EGFR单抗HLX07
HLX07是复宏汉霖自主研发的针对EGFR靶点的创新型生物药。基于公司成熟的抗体工程改造平台,复宏汉霖在西妥昔单抗的基础上,通过将HLX07的Fab区人源化,同时使该产品聚糖含量降至最低,以具备更低的免疫原性和良好的靶点亲和力。截至目前,复宏汉霖已就HLX07在中国、美国、欧盟、澳大利亚、日本等多个知识产权区获得专利,并在中国和美国获得临床试验许可。目前,公司围绕食管鳞癌、鳞状非小细胞肺癌、皮肤鳞癌等多个实体瘤适应症,正在积极开展HLX07单药或联合H药 汉斯状®(斯鲁利单抗)的II期临床探索。
HLX10HLX07-sqNSCLC-201
论文题目
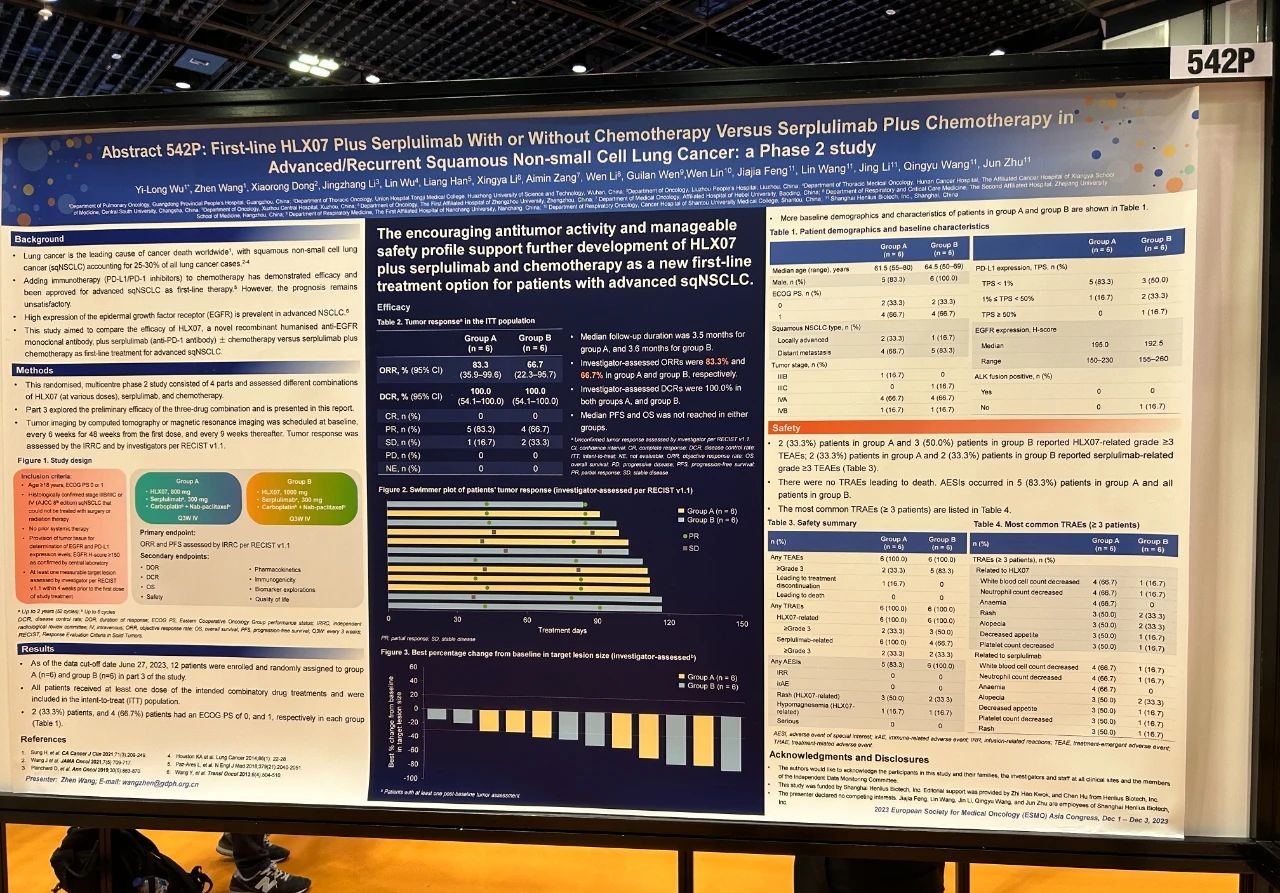
HLX07联合斯鲁利单抗与/不与化疗联用对比斯鲁利单抗联合化疗一线治疗晚期/复发性鳞状非小细胞肺癌:一项II期研究
这项随机、多中II期研究由四个阶段组成,旨在评估HLX07(不同剂量)、斯鲁利单抗和化疗的不同治疗组合的效果。第三阶段研究探索了三种药物联合治疗的初步疗效,其结果在下文中展示。研究纳入不能手术或放疗的、且之前未接受过系统性治疗的IIIB/IIIC或IV期鳞状非小细胞肺癌(sqNSCLC)患者,按1:1的比例随机分组,给予800 mg(A组)或1000 mg(B组)的HLX07静脉输注,联合300 mg的斯鲁利单抗和化疗(卡铂-白蛋白紫杉醇),每三周一次。主要终点是IRRC根据RECIST 1.1评估的ORR和PFS。
结果
截至2023年6月27日,第三阶段研究共入组12例患者并随机分配至A组(6例)和B组(6例)。患者的中位年龄为64岁。11(91.7%)例患者为男性。10(83.3%)例患者的疾病分期为IV期。中位随访时间为3.5个月时,A组和B组经研究者根据RECIST 1.1评估的未确认的ORR分别为83.3%(95% CI 35.9–99.6)和66.7%(95% CI 22.3–95.7)。两组的疾病控制率均为100.0%(95% CI 54.1–100.0)。A组的2(33.3%)例患者和B组的1(16.7%)例患者报告了严重的治疗期间出现的不良事件(TEAE)。B组的1(16.7%)例患者发生了3级特别关注不良事件(AESI)痤疮样皮炎;未发生4–5级AESI。研究未报告导致死亡的TEAE。
结论
HLX07联合斯鲁利单抗和化疗一线治疗晚期sqNSCLC患者有着良好的抗肿瘤疗效且安全性可控,值得进一步研究。
HLX07-CSCC201
论文题目
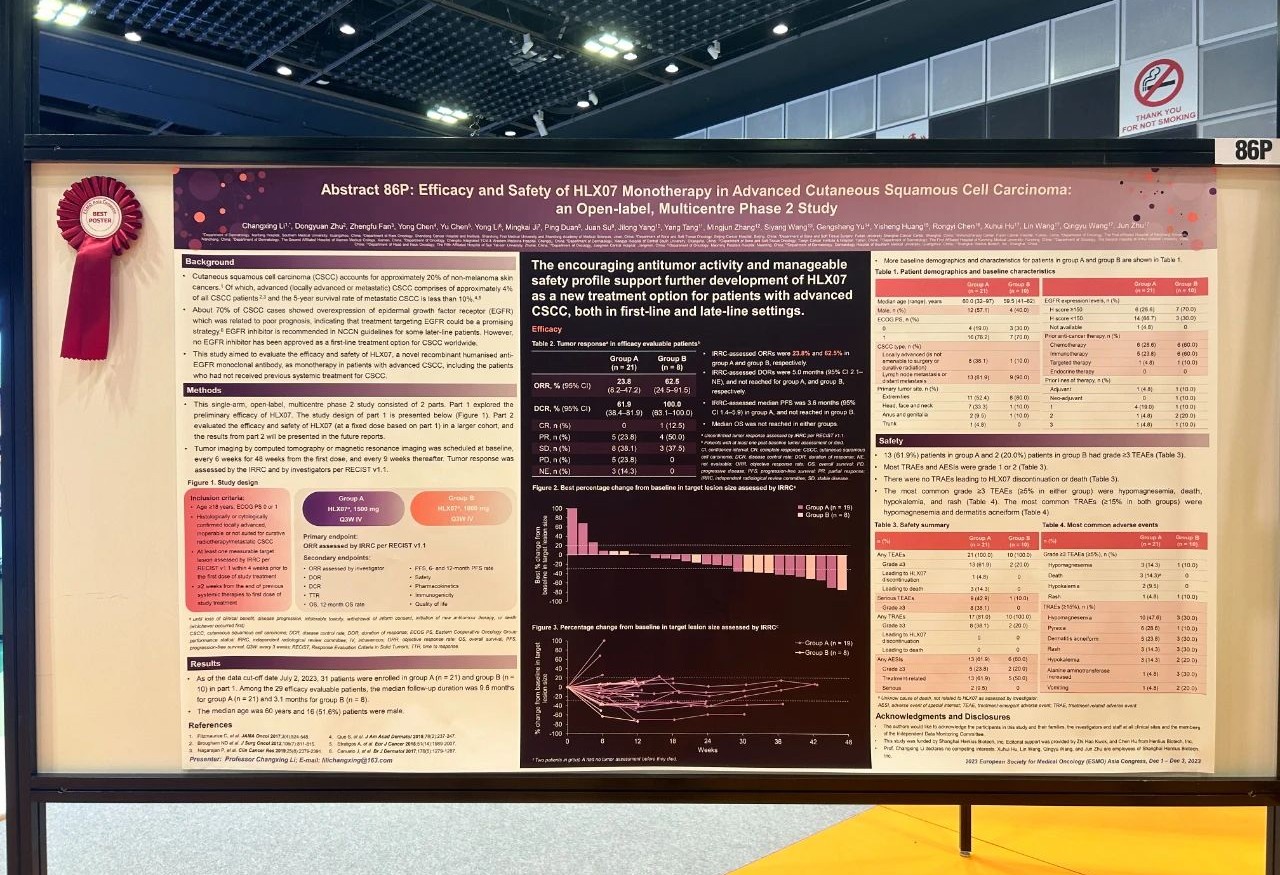
HLX07单药治疗晚期皮肤鳞状细胞癌的疗效和安全性:一项开放标签、多中心II期研究
试验设计
这项单臂、开放标签、多中II期研究分为两个阶段。第一阶段探索了初步疗效,其结果在下文中展示;第二阶段在更大的人群中评估了HLX07(基于第一阶段确定的固定剂量)的疗效和安全性。试验纳入患有伴淋巴结转移/远端转移的晚期CSCC或无法进行手术/无法进行根治性放疗的局部晚期CSCC患者,在第一阶段研究中接受1500 mg(A组)或1000 mg(B组)的HLX07静脉输注,每三周一次。主要终点是独立影像评估委员会(IRRC)根据RECIST 1.1评估的客观缓解率(ORR)。次要终点包括其他疗效指标、安全性、药代动力学特征、免疫原性和生活质量评估。
结果
截至2023年7月2日,第一阶段研究共入组31名患者,其中A组21例,B组10例。患者的中位年龄为60岁;16(51.6%)例患者为男性。在29例疗效可评估的患者中(A组21例,B组8例),A组与B组的中位随访时间分别为9.6个月和3.1个月。A组和B组患者经IRRC评估的未确认的ORR分别为23.8%(95% CI 8.2–47.2)和62.5%(95% CI 24.5–91.5)。A组经IRRC评估的中位PFS为3.6个月(95% CI 1.4–5.9),B组的中位PFS未达到。中位OS在两组患者中均未达到。在接受了研究治疗的31例患者中,A组和B组分别有8(38.1%)例和2(20.0%)例患者发生了≥3级的治疗相关不良事件(TRAE),最常见的是低镁血症(14.3% vs. 10.0%)和皮疹(4.8% vs. 10.0%)。研究未报告导致死亡的TRAE。
结论
HLX07单药治疗对晚期CSCC患者有着良好的抗肿瘤疗效和耐受性。
创新型抗LAG-3单抗HLX26
HLX26为复宏汉霖自主研发的靶向淋巴细胞活化基因3(lymphocyte-activation gene 3,LAG-3)胞外结构域的人源化单抗。通过阻断LAG-3介导的负信号通路,HLX26可使T细胞重新获得细胞毒性活性,从而恢复对肿瘤的杀伤功能。临床前研究表明,HLX26具有抗肿瘤活性以及良好的耐受性和安全性,尤其在临床前体外实验和动物模型中,H药与HLX26联用显示出了明显的肿瘤抑制协同效应,为两种产品的联合应用提供了科学依据,有力支持后续临床研究的开展。目前,H药联合HLX26双免疫治疗转移性结直肠癌(mCRC)的II期临床试验,及其一线治疗晚期非小细胞肺癌(NSCLC)的II期临床试验已相继完成首例患者给药。
HLX26-002
论文题目
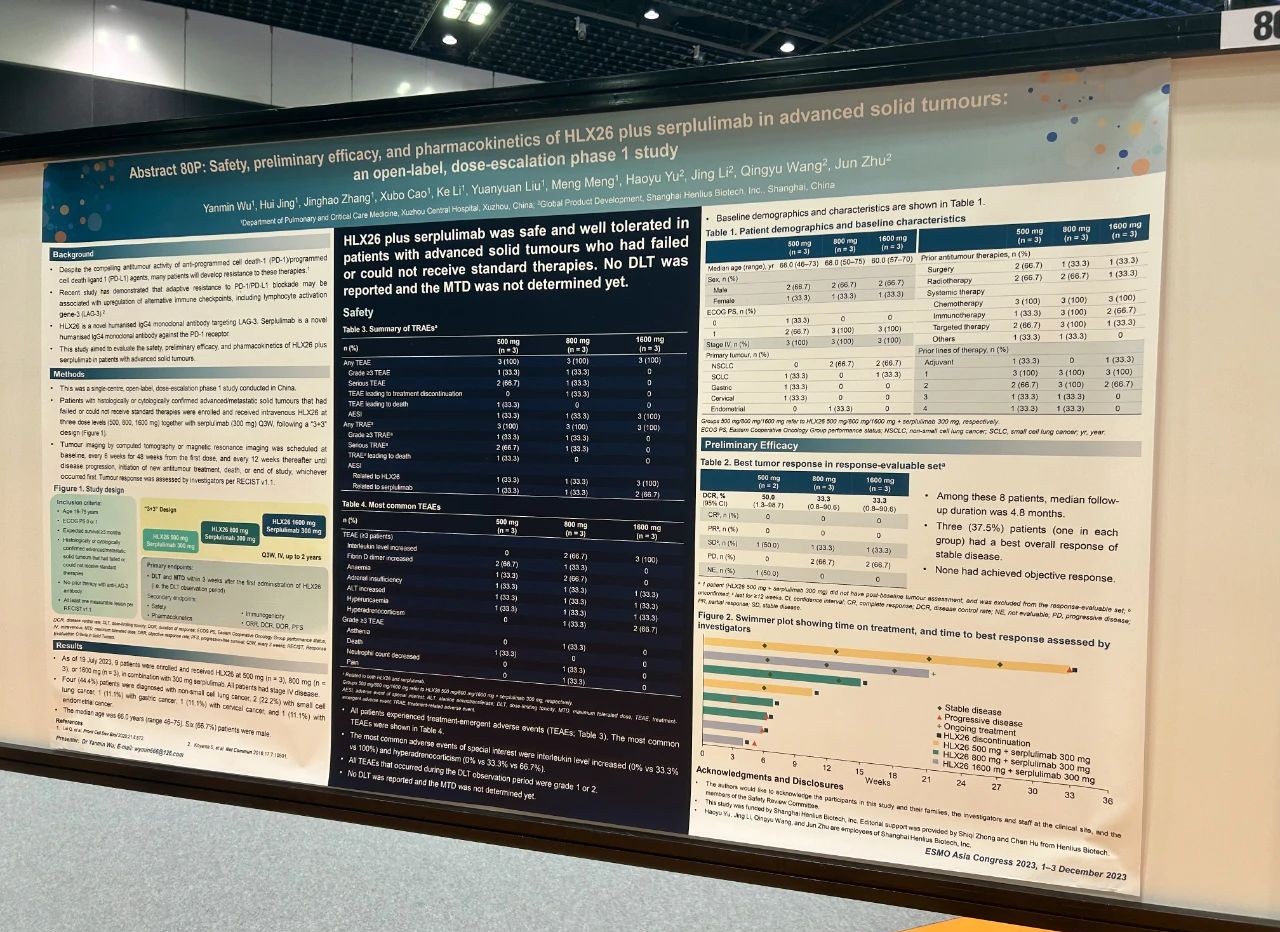
HLX26联合斯鲁利单抗治疗晚期实体瘤的安全性、初步疗效和药代动力学特征:一项开放标签、剂量递增的I期研究
试验设计
这是一项单中心、开放标签、剂量递增的I期研究。研究纳入组织学或细胞学确诊的经标准治疗失败或无法获得标准治疗的晚期/转移性实体瘤患者,采用“3+3”设计,给予患者三种剂量水平的HLX26(500、800、1600 mg)联合斯鲁利单抗(300 mg)的静脉输注,每三周一次。主要终点是HLX26首次给药后3周内(即剂量限制性毒性[DLT]观察期)的DLT和最大耐受剂量(MTD)。次要终点包括安全性、初步疗效、药代动力学特征和免疫原性。
结果
截至2023年7月19日,9例患有原发性IV期非小细胞肺癌(n=4,44.4%)、小细胞肺癌(n=2,22.2%)、胃癌(n=1,11.1%)、宫颈癌(n=1,11.1%)或子宫内膜癌(n=1,11.1%)的患者入组,并接受了500 mg(n=3)、800 mg(n=3)或1600 mg(n=3)的HLX26联合300 mg的斯鲁利单抗治疗。患者的中位年龄为66岁,6(66.7%)例患者为男性。治疗期间所有患者均发生了不良事件(TEAE);在DLT观察期内发生的所有TEAE均为1级或2级。800 mg组的一例患者报告了3级或4级药物相关的乏力、疼痛和中性粒细胞计数降低。研究未报告DLT,MTD尚未确定。在8例疗效可评估的患者中,无人达到完全或部分缓解;3(37.5%)例患者(每组各1例)的最佳总缓解为疾病稳定。
结论
不同剂量的HLX26联合斯鲁利单抗治疗未出现新的安全性信号。HLX26联合斯鲁利单抗在经标准治疗失败或无法获得标准治疗的晚期/转移性实体瘤患者中是安全且耐受性良好的。
