2023年6月6日,复宏汉霖(2696.HK)宣布,公司创新型BRAFV600E小分子抑制剂HLX208用于治疗BRAFV600E突变的成人朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)和Erdheim-Chester病(Erdheim-Chester disease,ECD)的II期临床研究(HLX208-LCH/ECD201)结果入选2023 ASCO年会,数据以海报形式展示。该研究由中国医学科学院北京协和医学院附属北京协和医院李剑教授牵头开展。2023年4月,HLX208被正式纳入突破性治疗品种名单,用于治疗BRAFV600E突变的LCH和ECD。
目前ECD与LCH均被认为属于炎性髓系肿瘤,严重影响患者生存质量,已被中国国家卫生健康委员会(卫健委)纳入《第一批罕见病目录》[1]。根据卫健委发布的《罕见病诊疗指南2019年版》[2],LCH与ECD的主要特征为MAPK/ERK信号通路激活,均存在超过50%的BRAFV600E基因突变率,所以 BRAFV600E是这两种罕见病的重要治疗靶点。HLX208具有全新的化学母核结构,是公司从润新生物引进的具备“同类最佳”潜力的BRAFV600E小分子抑制剂。临床前研究结果表明,HLX208具有单一稳定晶型,良好的口服生物利用度及显著的肿瘤抑制活性。早期临床研究也展现出HLX208具有良好的安全性、耐受性和有效性。此次ASCO年会上公布的数据详情如下:
论文题目
BRAFV600E抑制剂HLX208在携带BRAFV600E突变的朗格汉斯细胞组织细胞增生症和/或Erdheim-Chester病成年患者中的II期研究(摘要编号7574)
试验设计
此研究是一项单臂、开放标签、多中心的II期研究。试验纳入组织学确认的朗格汉斯细胞组织细胞增生症(LCH)和/或Erdheim-Chester(ECD)病的患者,给予每天两次口服HLX208 450 mg。HLX208的给药以28天为一个周期,直至疾病进展、出现不可耐受毒性、撤回知情同意、开始新的抗肿瘤治疗或死亡(以先发生的为准)。试验的主要终点是由独立评估委员会(IRC)根据实体瘤疗效PET评价标准(PERCIST)1.0评估的客观缓解率(ORR)。次要终点包括HLX208的安全性、其他疗效指标和药代动力学特征。
结果
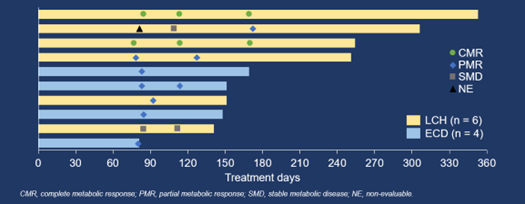
截至2023年1月15日,共22例LCH和/或ECD患者入组。所有患者都接受了至少一剂HLX208,并被纳入当前的分析。中位年龄是39岁(范围18–69)。9(40.9%)例患者为男性。12(54.5%)例患者被诊断为LCH,9(40.9%)例诊断为ECD,1(4.5%)例为LCH合并ECD。6(27.3%)例患者为单系统多病灶病变,16(72.7%)例为多系统病变。中位随访时间为4.8个月(95% CI 2.7–5.7)。
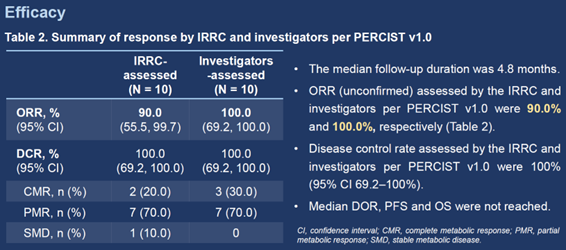
在10例可评估疗效的患者中,IRC根据PERCIST 1.0评估的ORR(未确认)为90.0%(95% CI 55.5–99.7%)(9/10,包括2例完全代谢缓解[CMR]和7例部分代谢缓解[PMR]),由研究者根据PERCIST 1.0评估的则为100.0%(95% CI 69.2–100.0%)(10/10,包括3例CMR和7例PMR)。由IRC和研究者根据PERCIST 1.0评估的疾病控制率均为100.0%(95% CI 69.2–100.0%)。中位持续缓解时间、中位无进展生存期和中位总生存期均未达到。
22例接受了HLX208治疗的患者中,17(77.3%)例报告了治疗期间出现的不良事件(TEAE);12(54.5%)例报告了治疗相关不良事件(TRAE),最常见的是丙氨酸氨基转移酶升高(36.4%)、天门冬氨酸氨基转移酶升高(22.7%)、γ-谷氨酰转移酶升高(18.2%)和血乳酸脱氢酶升高(18.2%)。大多数TRAE为一级(27.3%)和二级(18.2%)。试验未报告导致治疗终止或死亡的TEAE。
结论
HLX208安全性和耐受性良好,对LCH和/或ECD患者显示出良好的疗效。
参考文献
[1] 国家卫生健康委员会《关于公布第一批罕见病目录的通知》(国卫医发〔2018〕10号)http://www.gov.cn/zhengce/zhengceku/2018-12/31/content_5435167.htm
[2] 国家卫生健康委办公厅《罕见病诊疗指南(2019年版)》(国卫办医函〔2019〕198号)
