过去药物研发依循一套标准流程,通过比如全基因组的测序鉴定并克隆出跟疾病相关的基因,在细胞系和动物模型中进行临床前验证,然后经过优化并在动物模型中测试,最后到人体试验,当中只有部分的药物能够最后到达临床并且开发上市。这种方式已经成功地开发了许多有效治疗癌症的药物,包括乳腺癌及胃癌靶向HER2治疗,黑色素瘤BRAF抑制剂及针对非小细胞肺癌的EGFR和ALK抑制剂。尽管基于基因组研究的转化应用已大幅增加了我们对于疾病的理解,但是理解疾病进展及药物反应等过程仍旧需要我们更系统地了解基因调控、蛋白相互作用和功能的动态和时间差异。此外,识别出有效的生物标志物,将有助于帮助临床医生在临床治疗中依据患者不同分型给予合适的治疗方案。
多组学介绍[1-3]
除了基因组学的出现,外显子学、转录组、蛋白组学、表达基因组学(提供基因甲基化信息)也各自提供了不同且更精确丰富的信息。此外,转录后修饰(磷酸化及糖基化等)也会影响蛋白功能及下游信号传导。许多复杂性疾病,比如糖尿病,肥胖以及肠道炎症等,并不能单纯通过高通量筛选致病基因而找到病因,还需要综合考虑外部环境、生活及饮食习惯等因素。因此代谢组学及微生物组学作为多组学研究的一部分,也成为近年来的研究热点。代谢组学主要研究基因和环境相互作用的关系,不仅能够鉴定内源性代谢物形式的疾病生物标志物(基因衍生代谢物)和外源性代谢物(环境衍生的代谢物),还能提供对疾病根本原因的认识。一些研究认为,癌症在某种程度上可以被视为代谢紊乱的结果,例如自体产生的2hydroxyglutarate是一种致癌性代谢物(Oncometabolite),其在神经胶质瘤中的高浓度积累将会间接改变组蛋白的甲基化,从而导致癌症的发生。
迭代的组学分析方法从批量(Bulk)分析,精进到单细胞甚至是空间维度(spatial transcriptomics)使得科学家们能够绘制出多细胞类型之间相互作用的网络,为无论是在个体之间还是在个体内部的异质性的存在,揭示了新的疾病机制。高维单细胞技术允许在没有基因先验知识的情况下,对细胞进行测序并基于无监督分析依据细胞的转录特征进行分组。举例来说,2018年发表的健康人群的肝单细胞测序研究确定了20个离散细胞群,提供了人体肝脏的全面概述,以及这些细胞群的重要性及其对肝脏微环境的贡献;另一研究揭示了肝细胞癌中六种不同的巨噬细胞群体和一类新型的LAMP3+成熟树突状细胞,其抑制T细胞抗肿瘤功能。后续的更多研究也围绕不同组织或肿瘤的数据,对肿瘤免疫治疗相关的新抗原(neoantigens),免疫组成(immune contexture),肿瘤微环境(TME)以及宿主和环境因素提供了更多信息。例如,2017发表的Genomic cytometry (CITE-Seq)技术,是在单细胞水平上利用同时无偏差转录组测序及基于抗体标记细胞表面蛋白,来获得更详细的细胞表型特征,有助于在临床样本(如组织活检、癌症血液)有限的情况下进行分析。

from Brief Bioinform. 2019 May 21;20(3):767-777
举例多组学的实际应用
多组学的整合已在药物开发流程中显现出优势,且在药物开发的不同阶段均涌现出成功案例。例如在靶点发现阶段,利用小鼠和人类肿瘤模型进行全基因组筛选以系统性CRISPR筛选T细胞衰竭的遗传调节因子图谱,并找到表观遗传状态的调节分子,可以改善癌症免疫治疗中的T细胞反应[4]。
此外,另一涉及重新定位药物(drug reposition)的研究,通过创建疾病及正常组织样本的转录组表达谱、比较疾病特征和药物特征与疾病基因表达特征呈逆转的相关性,科学家们发现了一种新型GABA-B受体激动剂,有望治疗非酒精性脂肪性肝炎,并在临床前药效模型中得到验证[5]。
单细胞多组学方法可用于在临床试验期间加速细胞生物标志物的发现,如预测患者对治疗的反应,跟踪反应性细胞类型,并引导设计新的治疗策略。例如Docking等人利用多组学比较,鉴定了154名骨髓恶性肿瘤AML患者的多组学信息并制订了新的AML预后评分,这个研究也体现出转录组分析可以为特定患者提供新的治疗选择[6]。
以肝癌为例,针对病人群体检测DNA copy数目之间的变化以及 somatic mutation以及检测DNA甲基化,转录组、Micro RNA的表达以及蛋白之间的表达,结果显示,肝癌可分为三个亚型,其中一个相较于另外两个有较差的预后,此外每种亚型独特的分子特征及其不同的预后意味着需要不同的治疗策略[7]。
斯坦福大学医学院Mike Snyder 博士带领的集成的个人组学分析(integrated personal omics profiling (iPOP))以及西雅图系统生物学研究所(ISB)Leroy Hood博士建立的P4 medicine (predictive, preventive, personalized and participatory)项目定期收集数千位志愿者的多组学数据,一方面可用于评估每个人的健康状况并提高我们对疾病的理解,另一方面也有助于建立个人特定的生物标志物档案,以评估精准医疗的可行性。例如,iPOP分析对象的多数患者处于糖尿病早期,通过动态组学数据云可以了解疾病进展与生活方式、治疗方案等多种因素之间的相互关系。
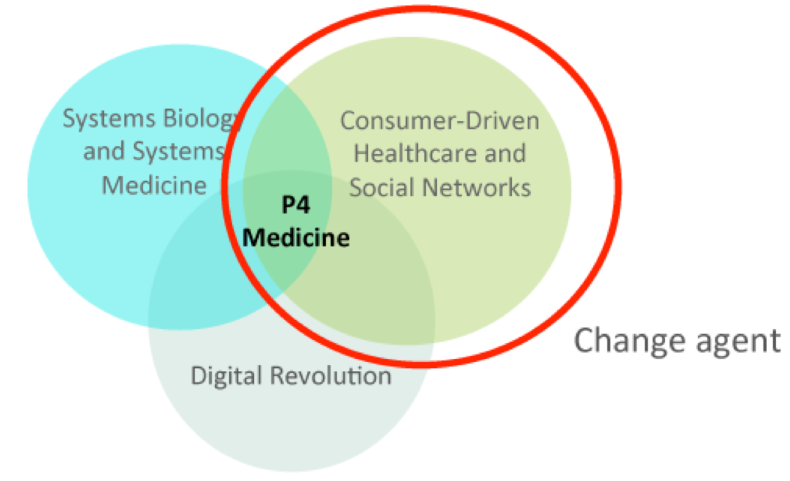
from https://www.esprevmed.org/p4-medicine/
机器深度学习方法助力组学整合及应用
近年来新兴开发的复杂机器学习技术已开始利用各领域大数据和深度学习加速药物研发流程,包括预测化合物物理性质和生物活性,生成新化合物,预测新的合成路径等。例如通过同源建模的方式,加速新冠病毒相关药物的标靶预测及筛选。基于多组学的模型训练无监督深度学习方法,也被成功用于预测肝细胞癌患者的生存期。深度学习通常需要大量的可靠数据样本来训练精确的模型。然而,临床样本的稀缺性和高异质性为建模带来不小挑战。2018年的一项泛癌分析表明,部分肝癌患者的肝脏样本和乳腺癌具有相同的细胞亚群,都具有ER-α、AR和GFBP2的高表达特征。因此,通过与其他癌症组学数据进行大规模比较,将有助于理解肝细胞癌机制,并通过借鉴其他癌种的现有疗法来指导肝细胞癌的治疗方案。
结语
多个转化模型(细胞系,类器官,动物模型,患者)、新兴数据类型(例如,微生物组代谢组数据)、真实世界的证据数据(例如成像和电子医疗数据)和生物标志物数据(特别是非侵入性生物标志物)的整合将全面指导未来药物开发。火星登陆计划旨在招募志同道合的伙伴,通过开发新的整合方法、分析多组学数据,加速对靶点开发优先级别的评估,针对复杂性疾病提出有效的多靶点治疗方案。
参考文献
[1] Zielinski J. M. et al., Front Immunol. 2021 Mar 31;12:590742.
[2] David S Wishart. Nat Rev Drug Discov. 2016 Jul;15(7):473-84.
[3] Papalexi E. and Satija R. Nat Rev Immunol. 2018 Jan;18(1):35-45
[4] Belk J.A. et al., Cancer Cell. 2022 Jul 11;40(7):768-786.e7.
[5] Bhattacharya D et al., Sci Rep. 2021 Oct 21;11(1):20827.
[6] Docking T.R. et al., Nat Commun. 2021 Apr 30;12(1):2474.
[7] Chen B. et. Al., Nat Rev Gastroenterol Hepatol. 2020 April ; 17(4): 238–251.
