在2019年11月22日至11月24日于新加坡举行的2019年欧洲肿瘤学会亚洲分会ESMO-Asia年会上,复宏汉霖分享了HLX10(重组抗PD-1人源化单克隆抗体注射液)治疗晚期实体瘤疗效及安全性的1期临床试验( NCT02648490)最新研究进展。
以下为本次数据发布的详细信息:
HLX10
论文题目:A Novel Anti-PD-1 Antibody HLX10 Study Led to the Initiation of Combination Immunotherapy
讲者:赵祖怡 卫生福利部双和医院
壁报编号:324P
时间:2019年11月23日18:00-18:30
地点:新加坡新达城国际会议展览中心展览大厅level4
近年来,程序性细胞死亡蛋白-1(PD-1)及其配体(PD-L1)因独特的作用机制和相对低的副作用等特点,引起了全球医疗研究人员的极大关注,并在众多肿瘤治疗领域取得了令人瞩目的成果。HLX10作为复宏汉霖自主研发的创新型单抗,体外试验被证实能够增强T细胞的功能,并在肿瘤移植模型中表现出抗肿瘤活性。今天,我们公布了HLX10在复发或转移性晚期实体瘤中1期临床试验的最新试验数据,该试验旨在探索HLX10在晚期或转移性实体瘤患者中的安全性、耐受性、剂量限制性毒性(DLT)、最大耐受剂量(MTD)、药代动力学(PK)和初步疗效。
试验设计
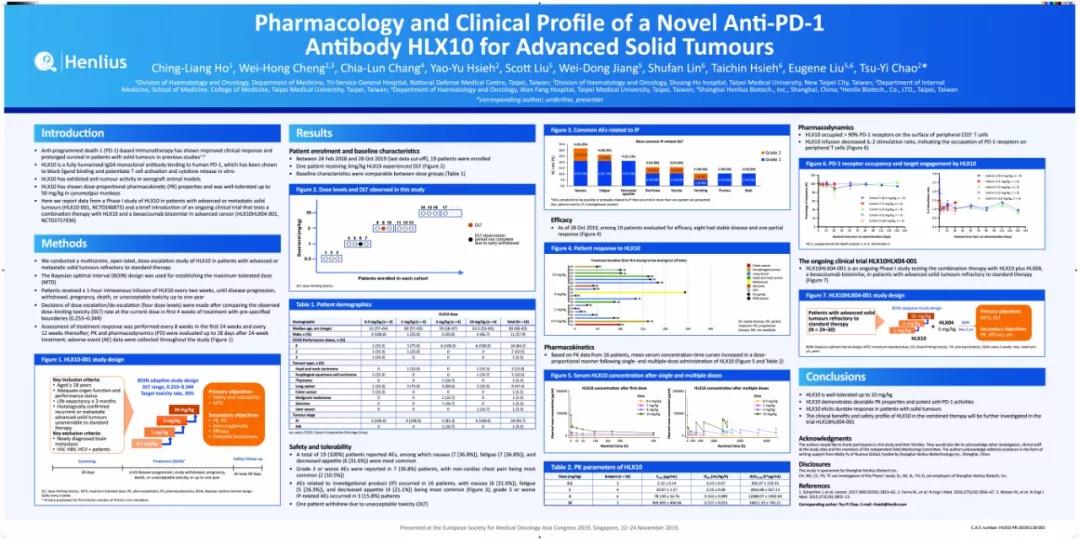
HLX10的1期临床试验为一项在标准治疗耐药的晚期或转移性实体瘤患者中开展的多中心、开放式的剂量递增试验。该研究采用贝叶斯最优区间(BOIN)设计,旨在探索HLX10的最大耐受剂量(MTD)。入组后,患者每两周静脉输注0.3,1,3,10mg/kg 的HLX10直至疾病进展, 退出试验, 死亡或治疗满12个月。首次给药28天内,观测剂量限制性毒性(DLT)。 临床疗效使用1.1版实体瘤的疗效评价标准(RECIST)和免疫RECIST(iRECIST)进行评估,前24周每8周评价一次,之后每12周评价一次。在试验期间,我们同步评估了HLX10的药代动力学、药效学特性和安全性。
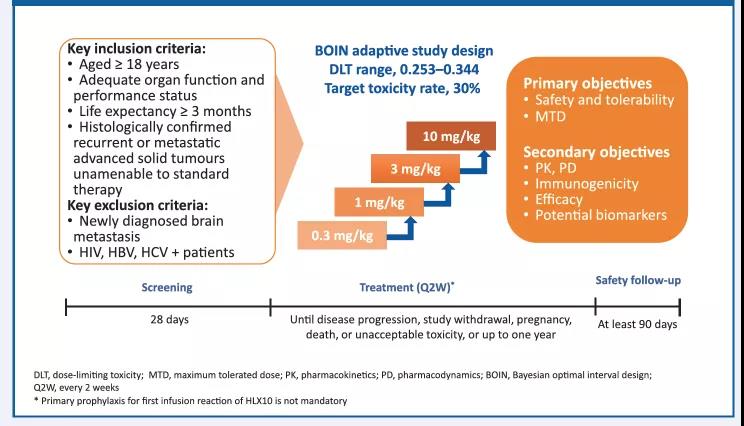
图1. 试验设计
试验结果
该试验在中国台湾开展。截止2019月10月28日,共入组患者19例,其中男性患者占57.9%,中位年龄为60岁。
有效性结果
在19例接受疗效评估的患者中,8例患者观测到疾病稳定(SD),在3mg/kg剂量组中1例达到部分缓解(PR)(图2)。
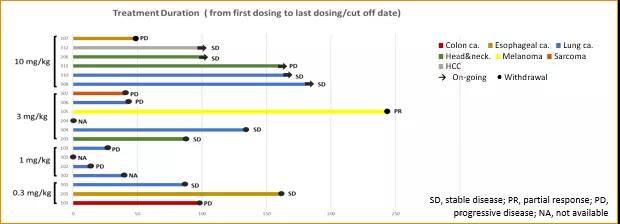
图2. HLX10有效性结果
药动学结果
HLX10药动学参数与计量呈正相关性。
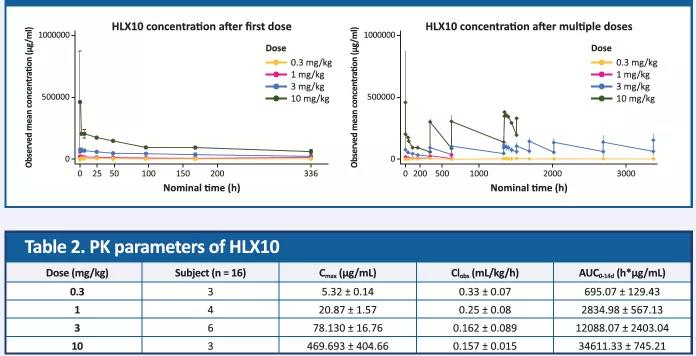
图3. HLX10 平均血药浓度(SD)-时间曲线
安全性结果
HLX10安全耐受性良好,大部分不良事件为1-2级。在3mg/kg剂量组,有1例患者达到剂量限制性毒性(DLT)。有7例患者发生大于3级的不良事件,其中,非心源性的胸痛最为常见(2【10.5%】)。
结论
• HLX10在复发或转移性实体瘤患者中的耐受性良好,单药治疗在多种实体瘤患者中表现出令人期待的抗肿瘤活性。
• 此外,HLX10的临床效果及安全性结果为正在进行的HLX10HLX04-001联合治疗试验提供了有力依据,进一步的试验将评估HLX10联合HLX04(贝伐珠单抗生物类似药)治疗标准疗法耐受的实体瘤患者。
