在2019年11月22日至11月24日于新加坡举行的2019年欧洲肿瘤学会亚洲分会ESMO-Asia年会上,复宏汉霖分享了HLX02(注射用曲妥珠单抗)的最新研究进展。

以下为本次数据发布的详细信息:
HLX02
论文题目:First China-Manufactured Trastuzumab Biosimilar HLX02 Global Phase 3 Trial Met Primary Endpoint in Breast Cancer
发布形式:Late-Breaking口头报告,编号LBA6
时间:2019年11月23日 09:12-09:24
地点:新加坡新达城国际会议展览中心 405会议室 乳腺癌专场
HLX02是复宏汉霖自主研发的注射用曲妥珠单抗,它的开发遵从国家药监局(NMPA)和欧洲药品管理局(EMA)生物类似药指导原则,旨在增加全球患者对曲妥珠单抗治疗的可及性。复宏汉霖先后于2018年CSCO大会和ESMO-Asia大会上发布了其1期临床试验(NCT02581748)的结果,验证了HLX02与不同来源的原研曲妥珠单抗(中国市售和欧洲市售)达到药代动力学生物等效,安全性相似。在今年CSCO大会上,复宏汉霖发布了HLX02 3期临床试验的部分亚组分析结果,并在ESMO大会上进一步报告了该试验不同分析集人群中的数据。HLX02 3期临床试验(HLX02-BC01, 临床试验号:NCT03084237;欧洲临床试验号:2016-000206-10)是一项在复发或未经治疗的HER2过度表达转移性乳腺癌患者中开展的随机、双盲、平行对照试验,旨在比较HLX02与原研曲妥珠单抗(欧洲市售)在乳腺癌患者中的有效性和安全性。现在,我们在ESMO-Asia 2019大会上报告了该试验在所有研究人群中用药24周的有效性结果及最新安全性数据。
此次HLX02 3期试验成功入选了ESMO-Asia大会Late-Breaking口头报告, 在23日上午新加坡新达城国际会议展览中心-405会议室进行口头报告。据悉,本次大会组委从众多乳腺癌领域入选的摘要中遴选出了5个重点研究,在乳腺癌领域的专题讨论(Proffered papersession-Breast cancer)中进行口头报告,并组织专家进行提问和讨论,该试验便是其一。本场讨论会由来自新加坡国家癌症中心的R.Dent教授主持。在讨论会现场,许多专家表示HLX02 3期临床研究的阳性结果令人喜悦,并对HLX02在提高患者可及性方面的市场潜力抱以期待。
试验设计
这项3期临床试验入组了来自4个国家(中国,乌克兰,菲律宾,波兰)89个研究中心既往未经治疗的复发性或转移性HER2阳性乳腺癌患者。入组患者需满足的主要条件为:≥18岁的成年女性且患有复发性或转移性乳腺癌、病理检测HER2阳性(FISH≥2.0或IHC得分3+)、未进行过全身性化疗或靶向药物治疗、体力状况较好(ECOG评分0~1)。患者按照1:1的比例随机分为两组,分别给予HLX02联合多西他赛治疗或原研曲妥珠单抗(欧洲市售)联合多西他赛治疗。两组患者均采用每3周一次,最多12个月的给药方案。主要疗效终点为24周(8个治疗周期)的最佳总缓解率(ORR24周)。

图1. 试验设计
试验结果
数据截止日期 2018年11月27日
有效性-主要终点
截止2018年11月27日,共649例患者被随机分配到两个治疗组(HLX02组=324;原研组=325)。HLX02组24周的最佳总缓解率为71.0%,原研组为71.4%,两组间无统计学差异。ORR24周组间差异为-0.4%,其95%置信区间 (-7.4%, 6.6%) 在预设等效区间内(-13.5%,+13.5%),HLX02和原研曲妥珠单抗(欧洲市售)疗效等效性成立。除此之外,亚组(亚洲 vs. 非亚洲,中国vs.非中国)分析显示,HLX02组与原研组ORR24周在不同人群中无统计学差异(p>0.05),进一步验证了HLX02与原研曲妥珠单抗(欧洲市售)的疗效相似性。
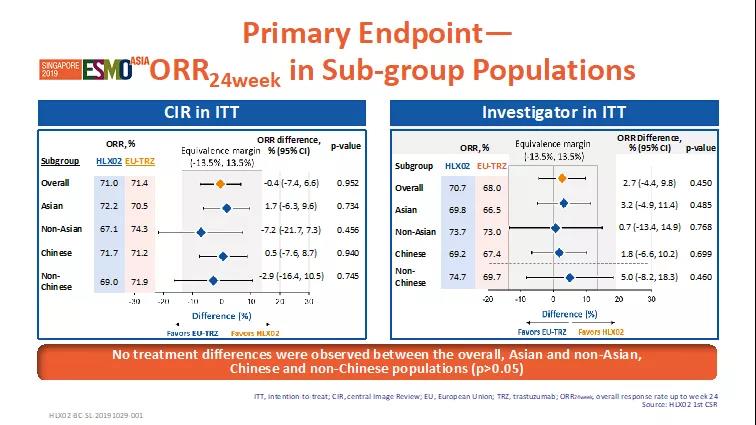
图2. 主要终点ORR24周-亚组分析
有效性-次要终点
次要疗效终点如临床获益率(CBR)、疾病控制率(DCR)、缓解持续时间(DoR)、无进展生存期(PFS)、总生存率(OS)等,两治疗组间无统计学差异(p>0.05)。
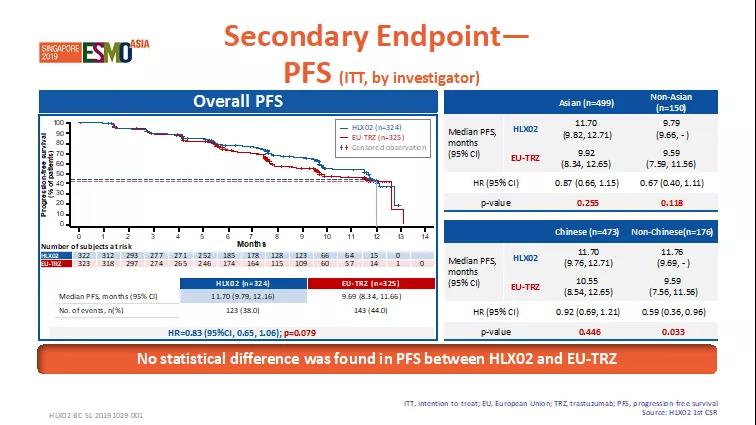
图3. 次要终点-无进展生存期PFS
安全性结果
HLX02和原研曲妥珠单抗(欧盟市售)安全性(包括心脏疾病相关的不良事件发生率, 图4)相似(p>0.05)。

图4. 安全性-药物相关的心脏疾病
结论
HLX02和原研曲妥珠单抗(欧洲市售)24周的最佳总缓解率组间差异95%置信区间在预设的等效区间内,两治疗组疗效等效性成立。截止到数据截止日,所有HLX02的次要疗效和安全性分析结果均支持HLX02与原研曲妥珠单抗(欧洲市售)在既往未经治疗的复发性或转移性HER2阳性乳腺癌患者中生物相似性成立。
